


氧化应激是恶性肿瘤的典型特征,癌细胞通过激活谷胱甘肽(GSH)合成通路维持还原状态以清除过量ROS1。xc−系统(由SLC7A11和SLC3A2组成的异源二聚体转运复合物)是GSH合成的关键调控系统,其中SLC7A11介导的胱氨酸摄取对维持GSH合成至关重要,抑制SLC7A11可诱导肿瘤细胞铁死亡2。最新研究发现,葡萄糖剥夺时,SLC7A11过表达会导致二硫化物累积,进而触发一种新型细胞死亡方式—双硫死亡3。这表明SLC7A11具有调控氧化还原稳态和程序性死亡的双重功能,但其在肿瘤微环境(TME)中的免疫调节作用仍有待深入阐明。
CD8+ T细胞作为抗肿瘤免疫的核心效应细胞,在TME中因持续抗原刺激而呈现耗竭表型4。TME中的多种代谢应激通过不同机制抑制CD8+ T细胞功能:缺氧通过诱导线粒体功能障碍促进T细胞耗竭5;乳酸积累抑制CD8+ T细胞的增殖和效应功能6;CD36介导的脂肪酸摄取引发脂质过氧化和铁死亡7,进而削弱其抗肿瘤能力。然而,TME中的双硫死亡介导的二硫键应激对CD8+ T细胞抗肿瘤功能的作用机制亟待研究。
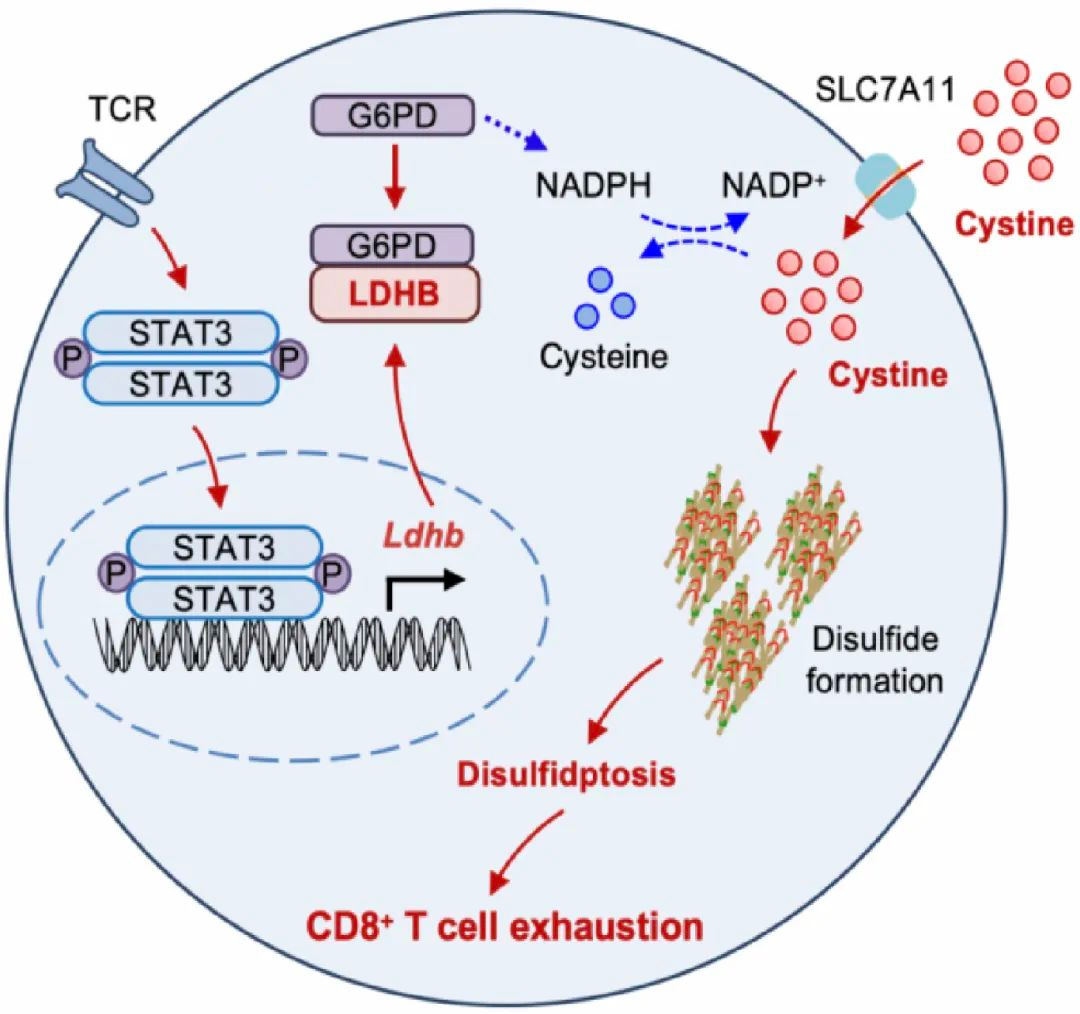
研究团队通过整合多组学数据、临床癌症患者标本及小鼠移植瘤模型等,发现肿瘤浸润耗竭CD8+ T细胞的双硫死亡水平显著上调;通过遗传学手段限制胱氨酸的摄取可显著降低肿瘤浸润CD8+ T细胞的双硫死亡水平,并有效改善其耗竭状态,从而提高其抗肿瘤免疫应答水平;利用条件性基因敲除小鼠证实,G6PD活性缺失导致NADPH生成障碍,进而促进双硫死亡;通过蛋白质组学筛选结合免疫共沉淀验证,鉴定LDHB与G6PD直接结合,进而抑制G6PD二聚体形成并降低其催化活性,从而促进CD8+ T细胞的双硫死亡;遗传学干预实验证实,特异性干预LDHB可有效逆转CD8+ T细胞的双硫死亡及耗竭水平;机制研究发现,肿瘤浸润耗竭CD8+ T细胞中转录因子STAT3可促进LDHB表达,以介导LDHB-G6PD相互作用并限制G6PD活性。本研究首次阐明STAT3-LDHB-G6PD信号轴在调控CD8+ T细胞双硫死亡及耗竭中的重要作用,为开发基于靶向干预LDHB的肿瘤免疫治疗新策略提供了重要理论依据。
上海交通大学医学院上海市免疫学研究所博士后万杰、河北大学附属医院史建红、上海交通大学医学院附属同仁医院施敏和上海交通大学医学院附属瑞金医院黄海燕为文章的共同第一作者。上海交通大学医学院上海市免疫学研究所邹强、河北大学附属医院李靖华、山东中医药大学李霞和上海交通大学医学院附属新华医院崔心刚为文章的共同通讯作者。该研究得到国家自然科学基金杰青、重点项目支持。
[ 参考文献 ]
1. Hayes, J. D., Dinkova-Kostova, A. T. & Tew, K. D. Oxidative Stress in Cancer. Cancer Cell 38, 167-197, doi:10.1016/j.ccell.2020.06.001 (2020).
2. Liu, X., Zhuang, L. & Gan, B. Disulfidptosis: disulfide stress-induced cell death. Trends Cell Biol 34, 327-337, doi:10.1016/j.tcb.2023.07.009 (2024).
3. Liu, X. et al. Actin cytoskeleton vulnerability to disulfide stress mediates disulfidptosis. Nat Cell Biol 25, 404-414, doi:10.1038/s41556-023-01091-2 (2023).
4. Philip, M. & Schietinger, A. CD8(+) T cell differentiation and dysfunction in cancer. Nat Rev Immunol 22, 209-223, doi:10.1038/s41577-021-00574-3 (2022).
5. Scharping, N. E. et al. Mitochondrial stress induced by continuous stimulation under hypoxia rapidly drives T cell exhaustion. Nat Immunol 22, 205-215, doi:10.1038/s41590-020-00834-9 (2021).
6. Quinn, W. J., 3rd et al. Lactate Limits T Cell Proliferation via the NAD(H) Redox State. Cell Rep 33, 108500, doi:10.1016/j.celrep.2020.108500 (2020).
7. Xu, S. et al. Uptake of oxidized lipids by the scavenger receptor CD36 promotes lipid peroxidation and dysfunction in CD8(+) T cells in tumors. Immunity 54, 1561-1577 e1567, doi:10.1016/j.immuni.2021.05.003 (2021).

邹强,上海交通大学医学院上海市免疫学研究所研究员,资深课题组长,课题组聚焦肿瘤免疫代谢,从机体宏环境和肿瘤微环境两个层面,解析肿瘤免疫应答与耐受的代谢调控机制,探索干预肿瘤免疫代谢提高肿瘤免疫应答的免疫治疗策略,已取得了多项重要学术成果,以通讯作者在Immunity、Nature Cell Biology、Cell Metabolism、Molecular Cell等学术期刊发表多篇论文。诚邀有志于肿瘤免疫代谢研究的青年才俊加盟,课题组将为优秀博士后的发展提供一流的科研条件与全方位的支持。
 沪公网安备 31009102000053号 沪ICP备18007527号-1 邮箱:sii@shsmu.edu.cn
沪公网安备 31009102000053号 沪ICP备18007527号-1 邮箱:sii@shsmu.edu.cn