


传统观点认为中性粒细胞是半衰期短、表型均质的循环免疫细胞。然而,近年来越来越多的研究证据表明,中性粒细胞可在特定组织中滞留,并分化为具有特化功能的亚型特征1,2。肺脏作为中性粒细胞重要的外周边缘池,其毛细血管中驻留着大量的中性粒细胞。尽管已有研究表明,肺部中性粒细胞在稳态下的基因表达特征区别于外周血中性粒细胞,但对其机制的阐述仍停留在趋化因子趋动的细胞招募-特化层面;考虑到肺部毛细血管直径(~5um),远小于中性粒细胞直径 (~10um),研究人员由此提出关键问题:中性粒细胞在肺部毛细血管网中经历的持续挤压是否在其肺特异性表型的建立过程中发挥了重要作用?
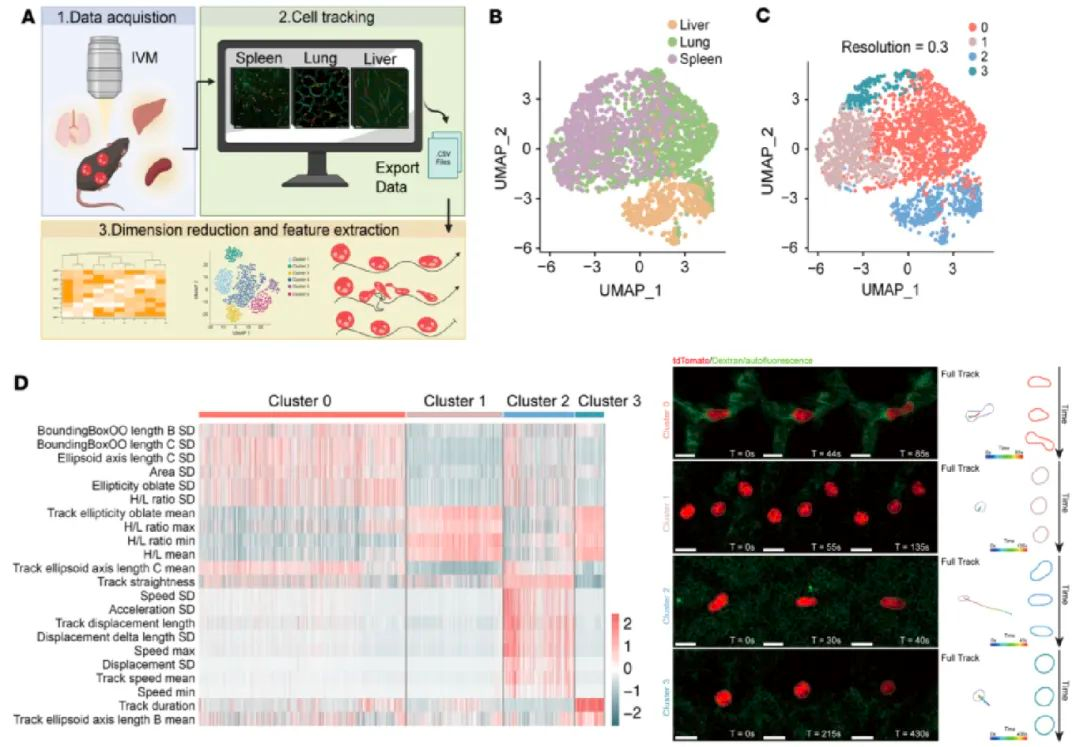
图一:中性粒细胞在不同组织中的行为图谱
为了探究这一问题,研究人员使用双光子显微镜对多器官进行了在体显微成像,观察稳态下中性粒细胞在不同器官中的运动模式和形态变化,并使用“behavioural landscape”3方法对追踪到的细胞轨迹与形态进行定量分析(图一) 。研究人员观察到肺部中性粒细胞在穿越微小毛细血管时发生显著细胞形变,且这些变形行为伴随短暂的钙离子内流(图二),提示机械刺激可能引起了钙信号产生。
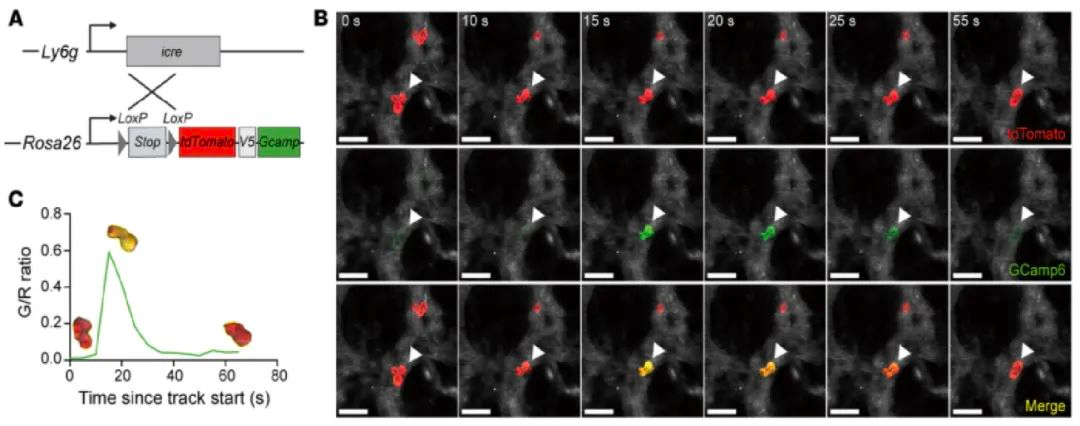
图二:肺毛细血管中的中性粒细胞存在与细胞形变偶联的钙离子内流事件
作为第二信使分子,钙离子负责调控一系列下游转录过程。对于外周血、骨髓、肺的单细胞及bulk RNA测序显示肺中性粒细胞具有独特的转录谱,包括高表达促血管生成及炎症相关基因(VEGFA, IL1B, CXCL1/2, IL6)等,这一转录特征在小鼠与人类中高度一致。研究人员进一步推测Piezo1作为机械力敏感受体,可能通过感知中性粒细胞形变产生的膜张力向胞内传递钙信号。对中性粒细胞的Piezo1进行条件性敲除后,肺部中性粒细胞钙信号减少,促血管生成相关基因及炎症基因表达下降,且肺毛细血管内皮细胞增殖受阻(图三)。
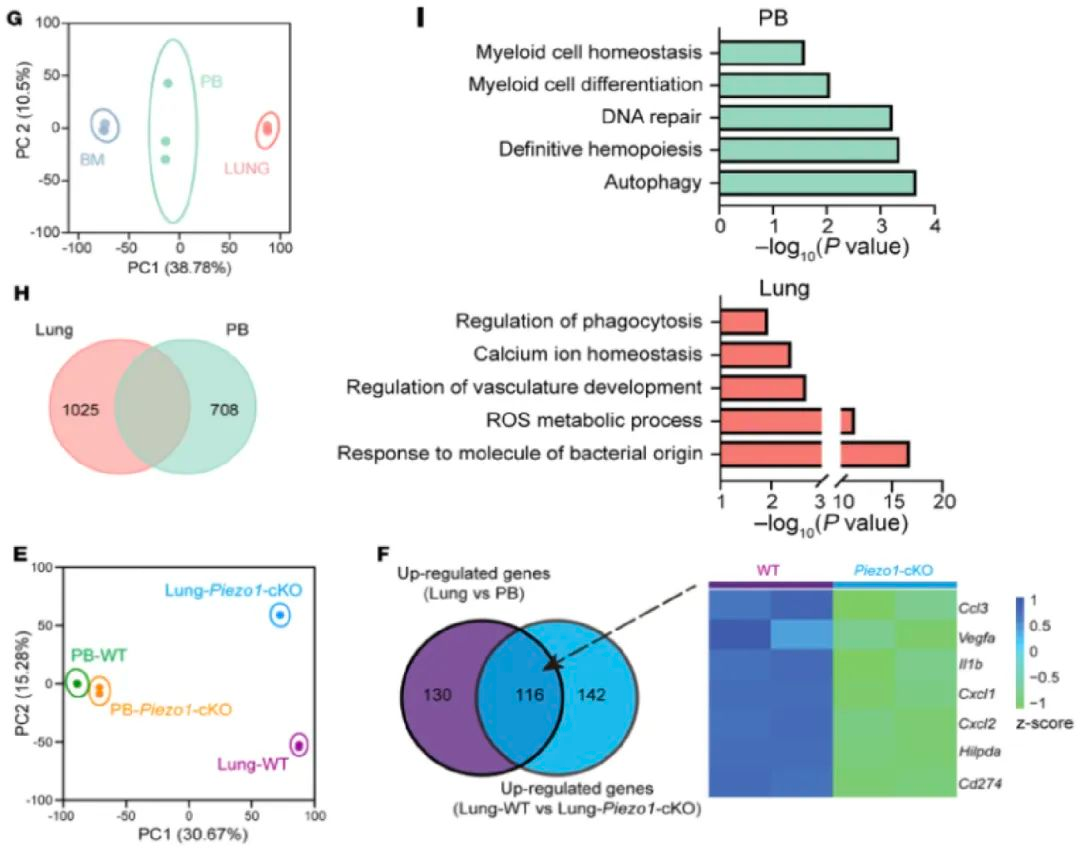
图三:肺中性粒细胞存在独特的转录特征,且这一特征受Piezo1调控
由于狭窄的毛细血管网络并非是肺部区别于其他组织的唯一特征,为了排除其他理化因素的干扰,研究人员使用微流控芯片模拟肺部狭窄的毛细血管网(图四)证明肺部中性粒细胞的独特表型依赖PIEZO1的存在。后续一系列分子生物学水平的实验证明了Piezo1激活后活化了下游的ERK/NF-κB通路,由此在中性粒细胞中上调了一系列肺特异性基因。在急性肺损伤和缺氧诱导的肺高压模型中,Piezo1条件性敲除小鼠小鼠表现出血管重塑缺陷,提示PIEZO1参与稳态和病理两种状态下的血管修复。
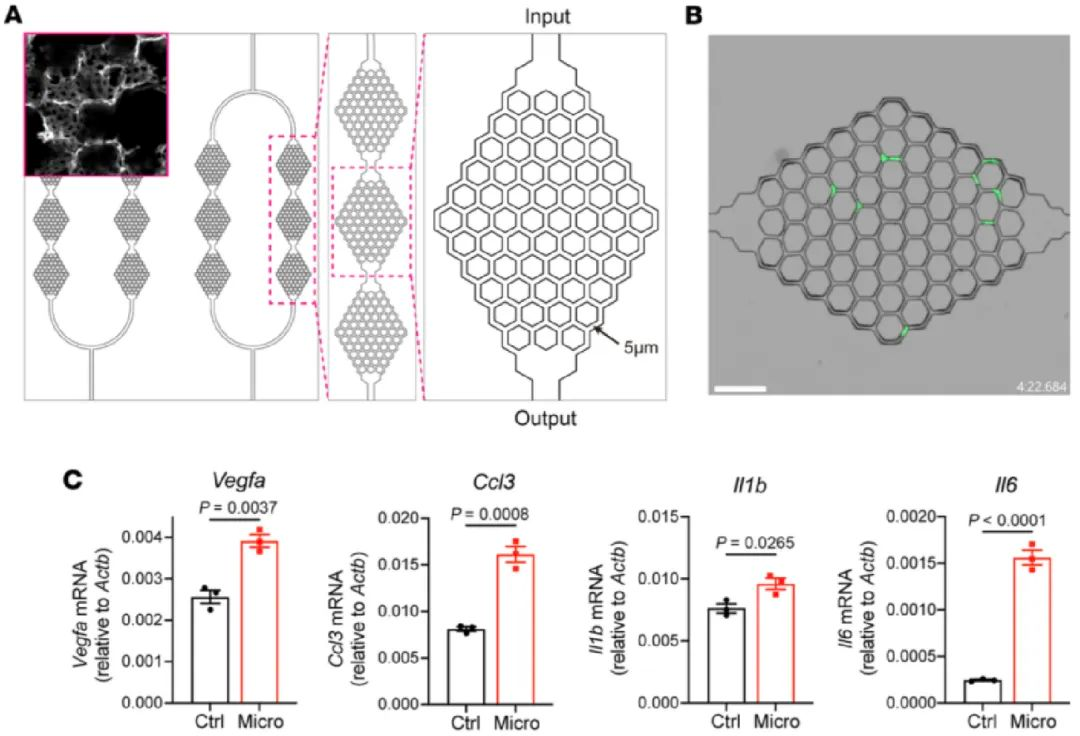
图四:中性粒细胞通过微流控芯片模拟的肺毛细血管后上调部分肺特征基因
本研究首次系统性地揭示了机械力作为组织微环境信号调控中性粒细胞表型重编程的关键作用,提出“组织微环境的物理特性”也是免疫细胞命运决定的重要“印记”信号,并揭示肺内毛细血管作为中性粒细胞功能‘重编程工厂’的核心地位,不仅拓展了当下对于中性粒细胞可塑性和异质性的理解,也为机械力调控先天免疫功能提供了理论依据和潜在治疗靶点。
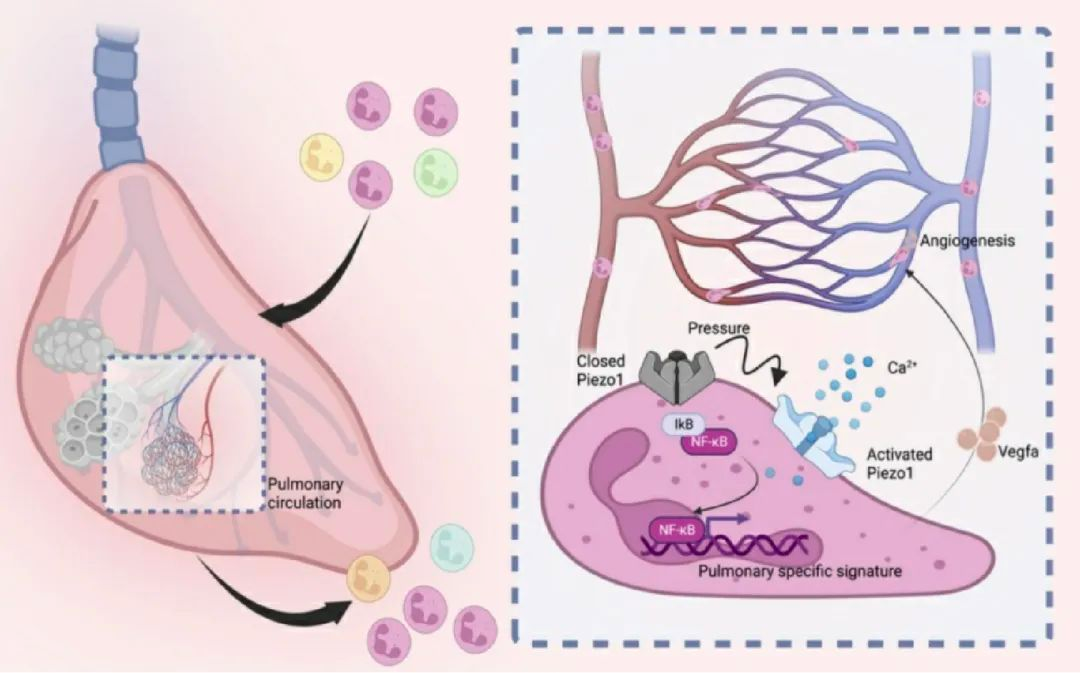
图五: 机械力-钙信号-ERK/NF-κB通路调控中性粒细胞表型重塑的示意图
上海交通大学医学院上海市免疫学研究所王静研究员、李斌研究员为本文的共同通讯作者;上海交通大学医学院2019级致远博士生王靳、2021级直博生赵文颖以及上海市免疫学研究所成像平台实验师柏文娟博士为本文的共同第一作者。感谢上海交通大学医学院徐天乐教授,加拿大卡尔加里大学Paul Kubes教授为本研究提供的实验支持和宝贵意见、瑞金医院胸外科李鹤成主任对临床样本的支持以及上海市免疫学研究所叶幼琼研究员对生信分析的帮助。耶鲁大学医学院Andres Hidalgo教授对于文章整体框架进行了修改和优化。上海交通大学医学院张大川研究员在文章写作及分子生物学实验方面进行了指导。该研究得到了国家自然科学基金重大研究计划资助,以及上海市免疫学研究所成像、测序平台的技术支持。
[ 参考文献 ]
1. Ballesteros, I. et al. Co-option of Neutrophil Fates by Tissue Environments. Cell 183, 1282-1297.e18 (2020).
2. Xie, X. et al. Single-cell transcriptome profiling reveals neutrophil heterogeneity in homeostasis and infection. Nat. Immunol. 21, 1119–1133 (2020).
3. Crainiciuc, G. et al. Behavioural immune landscapes of inflammation. Nature 601, 415–421 (2022).

王静,研究员,博士生导师,免疫所资深课题组长。团队善于结合活体显微成像、单细胞多组学等前沿工具,聚焦中性粒细胞等髓系细胞参与炎症反应的动态过程与功能调控机制的研究。以通讯/第一作者在Nature Immunology(2013),Cell(2016),Science(2017),Journal of Clinical Investigation(2025,2021), Nature Communications(2022,2023,2024), Cellular & Molecular Immunology(2024),Science Advances(2024)等国际知名学术期刊发表系列研究论文。入选国家自然科学基金委优秀青年基金、上海高校特聘教授(东方学者)。目前课题组已在中性粒细胞与巨噬细胞的动态行为及功能研究方向建立了成熟的实验体系与高分辨率活体显微成像平台。依托上海交通大学医学院上海市免疫学研究所的科研优势及附属医院丰富的临床资源,课题组致力于推动基础与转化研究的深度融合。诚邀有志于免疫学研究的青年才俊加盟,我们将为优秀人才的发展提供一流的科研条件与全方位的支持。

李斌,二级研究员、余㵑(Hè) 学者、上海交大特聘教授、国家基金委免疫学杰青、上海市领军人才、上海市优秀学术带头人,上海市免疫学研究所科研副所长&资深课题组长、瑞金医院免疫与疾病研究中心双聘研究员、上海市欧美同学会副会长&生物医药分会会长、中国生物物理学会感染与免疫分会副会长、CBIITA联盟免疫治疗药物分会主任委员、PENN Medicine China Club 副会长;European Journal of Immunology执行副主编、CMI编委、JGG 编委等。李斌研究员主要研究方向聚焦在FOXP3+调节性T细胞及其临床应用。先后承担国家基金委杰出青年基金、重点项目(3项)、移植免疫专项、中美及中波国际合作项目等。2009年回国以来,在国际一流学术期刊如Immunity、Nat Immunol、Nat Metab、J Clin Invest、PNAS等发表FOXP3+Treg领域一系列通讯及共同通讯作者论文一百余篇,H-index: 59,i10-index: 160。
 沪公网安备 31009102000053号 沪ICP备18007527号-1 邮箱:sii@shsmu.edu.cn
沪公网安备 31009102000053号 沪ICP备18007527号-1 邮箱:sii@shsmu.edu.cn