


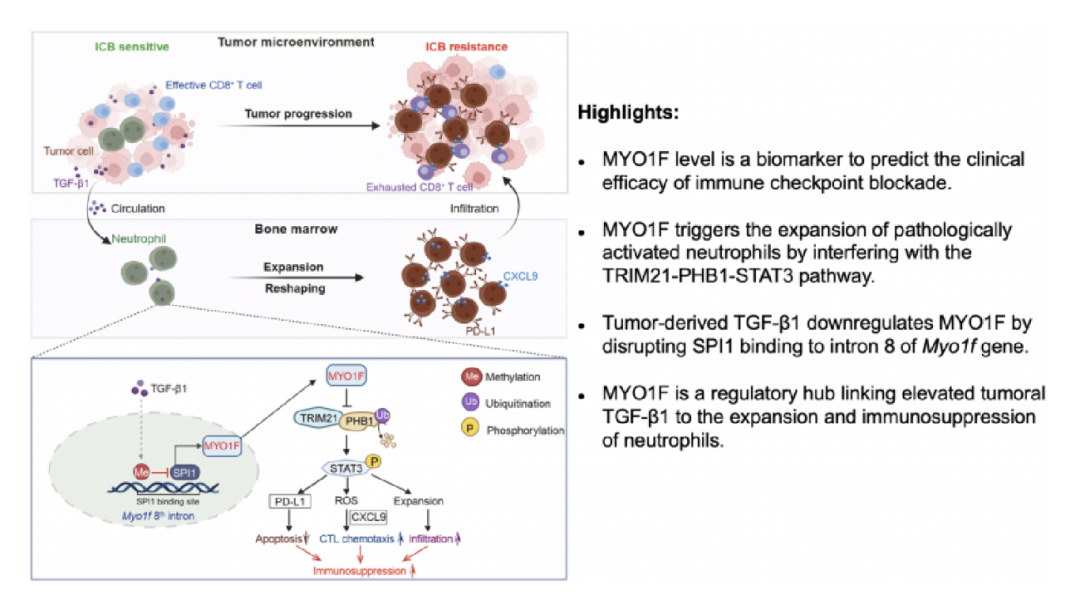
免疫检查点阻断疗法(Immune checkpoint blockade, ICB)为临床癌症治疗带来了革命性突破,但在大多数实体瘤患者仍存在低响应率的临床难题。浸润性肿瘤相关中性粒细胞(Tumor-associated neutrophils, TANs)是抑制ICB响应率的关键免疫抑制性群体,因此,深入解析TANs在实体瘤进展过程中的作用和相关调控机制,对预测ICB疗效和优化临床免疫治疗策略至关重要。
本团队研究发现,TANs中非常规I型肌球蛋白MYO1F的表达水平与ICB临床响应率存在显著负相关。进一步机制研究揭示,MYO1F通过TRIM21-PHB1信号通路抑制STAT3活性,进而限制TANs的增殖与免疫抑制功能。而在实体瘤发生发展过程中,肿瘤衍生的细胞因子TGF-β1通过DNA甲基化破坏中性粒细胞中SPI1与Myo1f基因内含子8的结合,从而抑制Myo1f的转录活性。MYO1F表达的下调促使中性粒细胞重新编程为STAT3信号依赖的增殖和免疫抑制状态,并通过诱导CD8+T细胞耗竭来全面重塑实体瘤免疫微环境。该研究揭示了MYO1F是TANs功能的关键调节因子,其表达水平不仅直接影响ICB的临床疗效,还可能作为预测实体瘤患者ICB治疗响应的潜在生物标志物,为精准免疫诊疗提供了新思路。
上海市免疫学研究所技术员渠颖颖、博士后梁文华为本论文共同第一作者,王锋研究员为本论文通讯作者。该研究工作得到国家自然科学基金重点项目,国家重点研发计划,上海市科学技术委员会和上海市地方高水平大学协同创新团队等经费支持。

王锋,上海市免疫学研究所课题组长、研究员、博士生导师。入选国家万人计划青年拔尖人才,东方学者特聘教授,上海市青年拔尖人才,上海市浦江人才和曙光学者。 2005年本科毕业于北京师范大学生命科学学院,2010年获得北京生命科学研究所(NIBS)和北京师范大学联合培养博士学位。2010-2016年在美国斯坦福大学医学院师从T细胞受体发现者,美国国家科学院院士Mark Davis教授进行博士后训练。长期致力于研究T细胞抗原识别和信号机制,以及抗原特异性T细胞在肿瘤等重大疾病免疫治疗中的作用。以通讯/第一作者在Nature Immunology、PNAS、 EMBO Journal等国际期刊发表系列研究论文。以第一发明人申请国家/国际专利13项,开展实体瘤TCRT免疫治疗临床试验。近五年主持国家自然科学基金重点项目、面上项目和国家重点研发计划等10余项国家级及省部级课题。
 沪公网安备 31009102000053号 沪ICP备18007527号-1 邮箱:sii@shsmu.edu.cn
沪公网安备 31009102000053号 沪ICP备18007527号-1 邮箱:sii@shsmu.edu.cn