


炎症反应是机体免疫防御的核心过程,既能有效消除病原体,也参与组织修复。然而,炎症反应失调可能导致一系列慢性炎症性疾病,包括炎症性肠病(IBD)、类风湿性关节炎(RA)、银屑病和系统性红斑狼疮(SLE),这些疾病统称为免疫介导的炎症性疾病(IMIDs),并可能进一步发展为危及生命的高炎症状态,如噬血细胞性淋巴组织细胞增多症(HLH)1–3。IMIDs的主要病理特征是巨噬细胞的异常激活,这不仅加剧组织损伤,持续性炎症加重。深入研究巨噬细胞活化的分子调控机制,对于精准干预炎症反应具有重要的科学价值和临床意义。
选择性多聚腺苷酸化(Alternative Polyadenylation, APA)是RNA代谢的重要调控机制,通过选择不同的多聚腺苷酸化位点生成不同长度的3'非翻译区(3'UTR),从而影响mRNA的稳定性、转运、翻译效率以及蛋白质的功能调控4,5。近年来,APA的功能逐渐被揭示,但其在免疫细胞中的调控作用和对炎症反应的影响尚未完全阐明。Nudt21是一种核心多聚腺苷酸化因子,其主要通过结合RNA序列,参与APA过程并调控3'UTR长度。然而,Nudt21在免疫介导的炎症性疾病中的作用及其对巨噬细胞功能的具体调控机制缺乏系统研究。
本研究发现,Nudt21在多种免疫介导的炎症性疾病中显著上调。为了进一步阐明Nudt21对巨噬细胞功能的影响,研究团队构建了巨噬细胞特异性Nudt21敲除小鼠模型(Nudt21-LyzMCre)。通过研究结肠炎和噬血细胞综合征两种炎症小鼠模型,发现Nudt21敲除显著降低炎症反应并缓解疾病进展,伴随促炎性细胞因子水平的明显降低(图1)。

图1.巨噬细胞特异性Nudt21敲除小鼠缓解炎症,伴随促炎细胞因子水平降低。
进一步结合高深度RNA测序和PDUI分析(多聚腺苷酸位点使用指数分析)发现,巨噬细胞中Nudt21敲除后自噬相关基因 Map1lc3b 和Ulk2的3'UTR缩短,mRNA稳定性增强,导致自噬活性显著提高。自噬激活降低了NF-κB信号通路的活性,抑制了促炎性细胞因子的释放。这表明,Nudt21通过调控自噬相关基因的3'UTR长度影响巨噬细胞的自噬活性,从而对炎症激活发挥重要的调节作用(图2)。

图2. Nudt21敲除后,自噬相关基因Map1lc3b和Ulk2的3'UTR缩短,mRNA稳定性增强。
该研究揭示了Nudt21通过3'UTR选择性多聚腺苷酸化(3'UTR-APA)调控自噬基因表达,从而影响巨噬细胞活化状态的分子机制(图3)。这一发现深化了人们对RNA代谢与巨噬细胞功能之间复杂关系的认识,为精准干预巨噬细胞介导的炎症反应提供了全新思路。未来,针对自噬基因3'UTR的调控策略有望成为治疗炎症性疾病的潜在靶点。
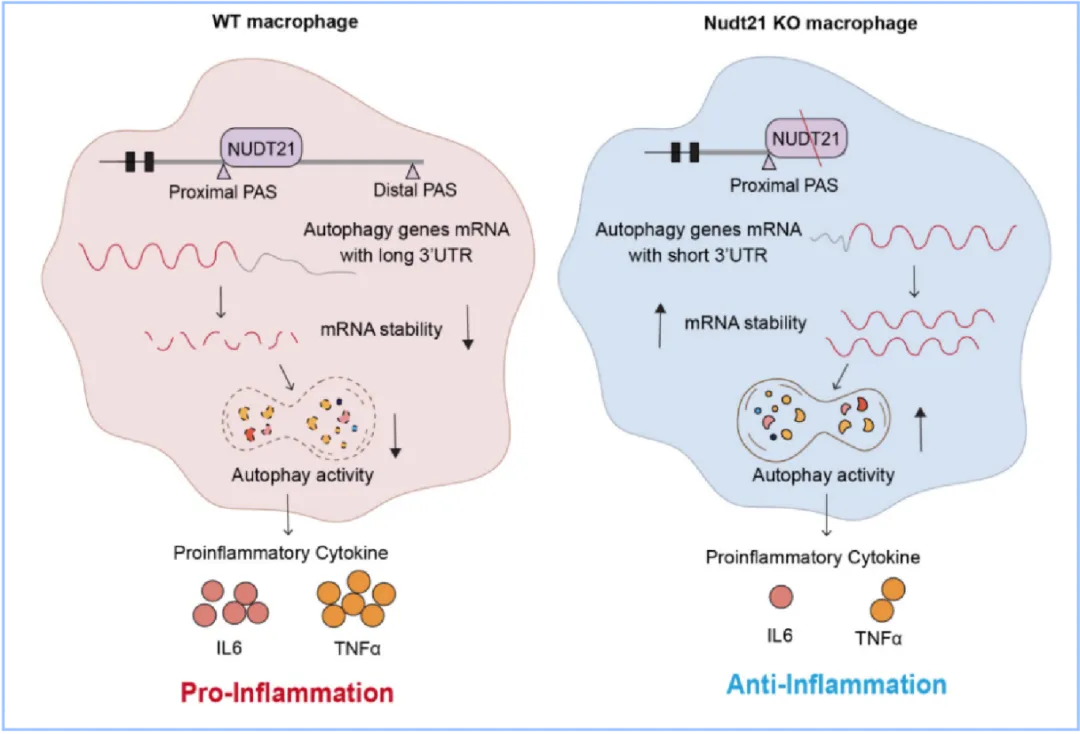
图3. Nudt21通过3'UTR选择性多聚腺苷酸化调控自噬基因mRNA稳定性,从而影响巨噬细胞炎性活化状态。
上海交通大学医学院上海市免疫学研究所博士研究生陈韵竹为本文的第一作者。上海交通大学医学院上海市免疫学研究所李华兵研究员为本文通讯作者。本研究得到国家自然科学基金委(杰出青年科学基金:82325024、专项项目:82341017、重点项目:82030042、面上项目:32070917)、上海市卫健委项目(新兴交叉领域研究专项:2022JC001、卫生健康学科带头人:2022XD047)资助,依托上海市免疫学研究所公共平台、上海交通大学医学院基础医学院公共技术平台、上海交通大学医学院动科部、赛业生物等平台的技术支持。本研究还得到了上海交通大学医学院病理生理学系张晶研究员、留筱厦副研究员、博士研究生郑邓昊,以及上海市免疫学研究所叶幼琼研究员等的指导与帮助。
文章链接:https://www.nature.com/articles/s41423-024-01237-8
Reference:
1 Chen Y, Chen B, Li J, Li H, Wang G, Cai X et al. Alternative mRNA polyadenylation regulates macrophage hyperactivation via the autophagy pathway. Cell Mol Immunol 2024; : 1–13.
2 Meizlish ML, Franklin RA, Zhou X, Medzhitov R. Tissue Homeostasis and Inflammation. Annu Rev Immunol 2021; 39: 557–581.
3 McInnes IB, Gravallese EM. Immune-mediated inflammatory disease therapeutics: past, present and future. Nat Rev Immunol 2021; 21: 680–686.
4 Grom AA, Horne A, De Benedetti F. Macrophage activation syndrome in the era of biologic therapy. Nat Rev Rheumatol 2016; 12: 259–268.
5 Anderson P. Post-transcriptional control of cytokine production. Nat Immunol 2008; 9: 353–359.
6 Tian B, Manley JL. Alternative polyadenylation of mRNA precursors. Nat Rev Mol Cell Biol 2017; 18: 18–30.

李华兵,二级教授,博士生导师,重庆医科大学副校长,免疫创新与转化研究院院长;上海交通大学医学院上海市免疫学研究所资深研究员,上海交通大学医学院附属瑞金医院老年医学中心特聘教授;耶鲁大学医学院免疫生物学系兼聘教授;国家杰出青年基金获得者。
2002年本科毕业于南开大学并于2005年获得南开大学硕士学位,2011年在新泽西州立大学获得博士学位,2017年在耶鲁大学完成博士后研究。2017年8月正式入职上海交通大学医学院上海市免疫学研究所/上海交通大学医学院基础医学院免疫学与微生物学系担任课题组长,建立RNA表观免疫课题组。2024年6月起调任重庆医科大学党委常委、副校长,兼任重庆医科大学免疫创新转化研究院院长。
最近五年的相关研究成果以通讯(含共同通讯)作者身份发表于 Nature、Nature Immunology(封面)、Immunity、Nature Aging、Cell Research、PNAS、Science Advances(3篇)、Nature Communications等国际学术期刊。作为项目负责人主持国家自然科学基金委员会医学部免疫学国家杰出青年科学基金、原创探索计划项目、肿瘤微环境重点专项项目、重点项目、国际合作与交流项目、面上项目、重大研究计划培育项目,上海市卫生健康专项,上海市“科技创新行动计划”项目和科技部重点研发计划子课题等国家和上海市项目;入选上海市卫生健康学科带头人、国家海外高层次青年人才项目和上海市“东方学者”特聘教授等人才项目。担任中国免疫学会常务理事、中国免疫学会基础免疫分会委员,中国细胞生物学会免疫细胞生物分会常务理事、副秘书长,上海市免疫学会常务理事、上海市免疫学会青年工作委员会主任委员等学术职务。
李华兵课题组近年来深入系统地研究RNA修饰如何调控免疫细胞的功能以及在肠道炎症和肿瘤发生发展中的作用,现根据课题研究的需要,课题组面向社会公开招聘,欢迎更多优秀的人才(包括博士后和技术员)加入团队共同推进课题进展,课题组将为拟加入的成员提供具有竞争力的待遇、一流的研究平台和良好的发展前景。
更多信息请参考课题组网页:https://hua-binglilab.com/
 沪公网安备 31009102000053号 沪ICP备18007527号-1 邮箱:sii@shsmu.edu.cn
沪公网安备 31009102000053号 沪ICP备18007527号-1 邮箱:sii@shsmu.edu.cn