2023年02月20日,上海交通大学医学院上海市免疫学研究所叶幼琼研究员团队在Nature Communications 上发表题为“Reconstruction of the tumor spatial microenvironment along the malignant-boundary-nonmalignant axis”的研究论文。该研究开发了肿瘤空间微环境解析工具Cottrazm (Construction of Tumor Transition Zone Microenvironment), 结合空间转录组数据和HE染色图像以及单细胞转录组数据,精准绘制了肿瘤组织中连接恶性和非恶性区域的肿瘤边界区域,利用反卷积的方法解析不同空间定位上的细胞组成,并在sub-spot水平重构细胞类型特异的基因表达谱。利用该工具以结直肠癌和肝癌的肿瘤样本为例,发现在肿瘤边界富集的特定细胞亚型、细胞互作、以及靶向边界的潜在治疗靶点,为临床靶向肿瘤空间微环境治疗提供了新策略。
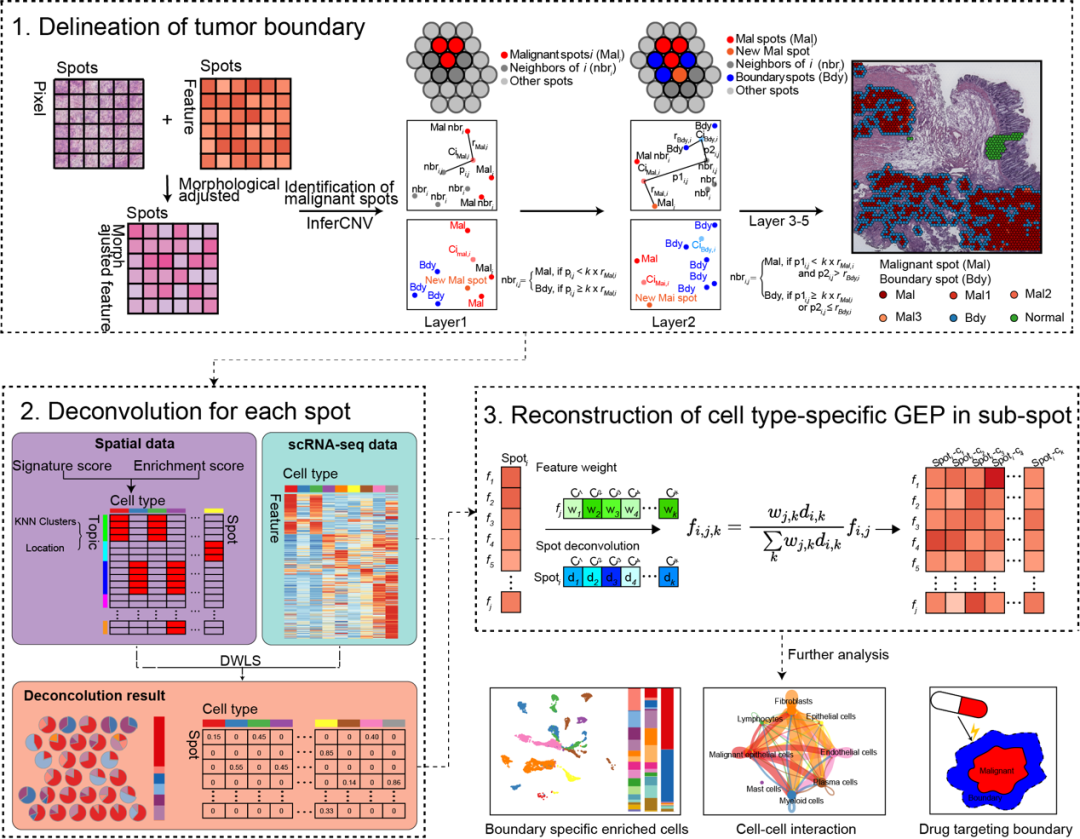
肿瘤边界是由位于实体瘤最外层的恶性细胞和在空间结构上紧密相连的非恶性细胞构成的、连接恶性和-非恶性空间组织的桥梁。尽管肿瘤边界的细胞组成、细胞相互作用和分子网络调控都对肿瘤微环境(Tumor microenvironment, TME)重塑有重要影响,但肿瘤边界的概念通常是由科学家或病理学家基于IHC染色数据进行主观描述,长期以来缺乏明确的标准或一致的方法[1]。
空间转录组 (Spatial transcriptomics, ST) 结合单细胞转录组测序 (single-cell RNA sequencing, scRNA-seq) 的优势在于可以直接在组织上赋予基于表达谱二维空间信息。大多原位捕获技术诸如10X Genomics Visium, 往往在一个空间点中包含多个同质或异质细胞,使得准确定义空间点的细胞组成具有挑战性。传统的ST分析工具通常聚焦于图像分析、细胞类型定义、反卷积、空间分布、细胞间相互作用和空间基因表达模式等[2-5],目前尚无针对肿瘤边界的分析工具,很大程度上限制了对肿瘤边界的细胞组成、边界中不同类型细胞间相互作用以及基于肿瘤边界的潜在治疗靶点的研究。
叶幼琼研究团队开发了肿瘤空间微环境解析工具Cottrazm,一个基于10x Genomics Visium平台ST测序构建肿瘤边界周围微环境的R包 (图1)。本项研究中首先利用Cottrazm界定了连接恶性和非恶性空间点的肿瘤边界 (Cottrazm-BoundaryDefine);其次通过整合scRNA-seq、空间转录组学和空间点的位置信息通过反卷积算法预测空间各点的细胞组成 (Cottrazm-SpatialDecon);最终利用ST和scRNA-seq数据在sub-spot水平重建了细胞类型特异的基因表达谱 (Cottrazm-SpatialRecon)。
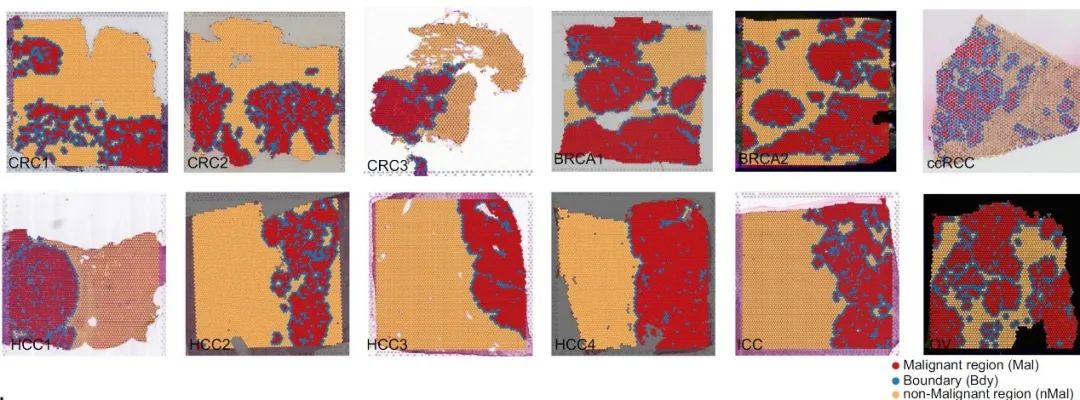
研究进一步利用ST模拟数据验证了Cottrazm在空间点的细胞浸润预测和空间sub-spot的细胞类型特异性基因表达谱的预测上具有较高的准确性和敏感性。研究团队利用Cottrazm分析了6种冰冻肿瘤组织的13个ST数据集和2种福尔马林固定石蜡包埋 (FFPE) 癌症组织的3个ST数据集, 结果显示所有样本均可勾勒出清晰的肿瘤边界从而区分恶性区域和非恶性区域(图2)。同时以结直肠癌(Colorectal Cancer,CRC)为例,反卷积预测CRC样本中每个空间点(spot)的细胞组成,三个区域的细胞组成显示绝大多数恶性spot主要由肿瘤细胞组成,缺少T细胞或其他类型细胞的浸润;边界spot主要由髓系细胞,成纤维细胞和内皮细胞组成;非恶性spot中不含肿瘤细胞且在不同组织区域细胞组分特征不同。为进一步解析CRC空间微环境,本研究重构了每个spot中各亚类细胞(sub-spot)的基因表达图谱(Gene Expression Profiles, GEPs),并在sub-spot水平进行细胞亚群重注释(图3)。深入分析显示,具有肿瘤免疫排斥型微环境的CRC和肝癌(HepatoCellular Carcinoma,HCC)中髓系细胞亚群Macro-SPP1和成纤维细胞亚群Fib-ASPN在肿瘤边界富集并和恶性上皮细胞相互作用形成屏障,阻碍T细胞在恶性区域的浸润,为未来靶向肿瘤边界的治疗筛选了潜在靶点。
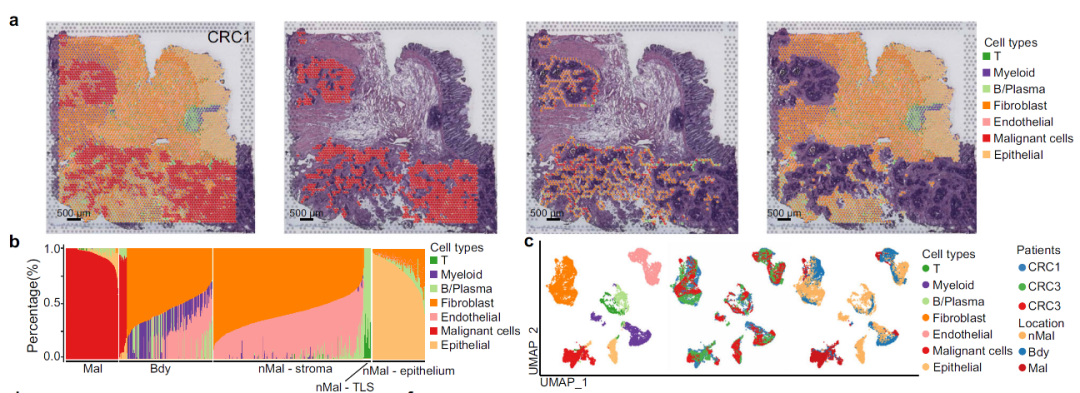
图2. Cottrazm精准绘制不同癌种中恶性肿瘤区域(红色)、肿瘤边界区域(蓝色)和非恶性区域(橙色)

图3. Cottrazm预测肿瘤空间微环境中不同区域的细胞组成和对应细胞的表达图谱
综上,新开发的 Cottrazm工具为ST数据依赖的TSME解析提供了基于恶性-边界-非恶性轴的新方法,可用于肿瘤边界的空间位置、细胞组成、基因表达谱、生物学功能、细胞相互作用分析和潜在治疗靶点的挖掘。从临床转化的角度来看,利用该工具以结直肠癌和肝癌的肿瘤样本为例,发现在肿瘤边界富集的特定细胞亚型、细胞互作、以及靶向边界的潜在治疗靶点,该工具可以推广到泛癌中使用,为临床靶向肿瘤空间微环境治疗提供了新治疗策略。
上海市免疫学研究所叶幼琼研究员和美国Texas A&M大学韩冷教授为该文的共同通讯作者, 上海市免疫学研究所博士研究生荀臻臻为本论文的独立第一作者。该研究得到了上海市免疫学研究所苏冰教授在空间边界微环境概念构思等方面的大力支持。该工作受国家自然科学基金、上海市科学技术委员会先导项目的支持。同时感谢上海市免疫学研究所测序平台的支持。
 叶幼琼,研究员,博士生导师,上海交通大学医学院/上海市免疫学研究所课题组长(PI)(http://www.yelab.site/)。课题组围绕肿瘤(边界)微环境,以生物大数据为驱动,构建算法、开发工具,结合生物信息分析、基础实验、临床队列研究等阐释肿瘤边界微环境中重要调控因子对肿瘤进展及免疫逃逸的作用机制;并利用多维数据构建免疫治疗疗效预测模型,为免疫治疗研究提供新思路新策略。相关研究成果以最后(共同)通讯作者、第一(共同)作者发表在Nature Metabolism (2019)、Nature Immunology (2019)、Cancer Cell (2020)、Nature Communications(2020,2022,2023)、Cancer Research (2023)等期刊。叶幼琼课题组长期招收博士后,具有生物信息学和肿瘤免疫学等相关背景优先,欢迎更多优秀的人才(包括博士后、助理研究员、技术员)加入。请感兴趣的申请者来函咨询:youqiong.ye@shsmu.edu.cn。
叶幼琼,研究员,博士生导师,上海交通大学医学院/上海市免疫学研究所课题组长(PI)(http://www.yelab.site/)。课题组围绕肿瘤(边界)微环境,以生物大数据为驱动,构建算法、开发工具,结合生物信息分析、基础实验、临床队列研究等阐释肿瘤边界微环境中重要调控因子对肿瘤进展及免疫逃逸的作用机制;并利用多维数据构建免疫治疗疗效预测模型,为免疫治疗研究提供新思路新策略。相关研究成果以最后(共同)通讯作者、第一(共同)作者发表在Nature Metabolism (2019)、Nature Immunology (2019)、Cancer Cell (2020)、Nature Communications(2020,2022,2023)、Cancer Research (2023)等期刊。叶幼琼课题组长期招收博士后,具有生物信息学和肿瘤免疫学等相关背景优先,欢迎更多优秀的人才(包括博士后、助理研究员、技术员)加入。请感兴趣的申请者来函咨询:youqiong.ye@shsmu.edu.cn。
【参考文献】
1. Ji, A. L. et al. Multimodal Analysis of Composition and Spatial Architecture in Human Squamous Cell Carcinoma. Cell 497–514 (2020).
2. Rao, A., Barkley, D., França, G. S. & Yanai, I. Exploring tissue architecture using spatial transcriptomics. Nature 596, 211–220 (2021).
3. Asp, M., Bergenstråhle, J. & Lundeberg, J. Spatially Resolved Transcriptomes—Next Generation Tools for Tissue Exploration. BioEssays 42, 1–16 (2020).
4. Liao, J., Lu, X., Shao, X., Zhu, L. & Fan, X. Uncovering an Organ’s Molecular Architecture at Single-Cell Resolution by Spatially Resolved Transcriptomics. Trends Biotechnol. 39, 43–58 (2021).
5. Ståhl, P. L. et al. Visualization and analysis of gene expression in tissue sections by spatial transcriptomics. Science vol. 353 78–82 (2016).
 沪公网安备 31009102000053号 沪ICP备18007527号-1 邮箱:sii@shsmu.edu.cn
沪公网安备 31009102000053号 沪ICP备18007527号-1 邮箱:sii@shsmu.edu.cn