近日,著名学术期刊Nature Communications在线发表了上海交通大学公共卫生学院宋海云研究员、季晓媛副研究员和上海师范大学化学与材料科学学院陈楠教授团队题为“Dual asparagine-depriving nanoparticles against solid tumors”的研究成果。该研究设计和构建了一种具有可拆分核-壳结构的天冬酰胺双重剥夺纳米粒子,通过干预肿瘤细胞对外源天冬酰胺的摄取及其内源性合成,抑制实体肿瘤生长、复发及远端转移,并可诱导T细胞产生长期的抗肿瘤免疫记忆,为改善氨基酸耗竭疗法在实体肿瘤中的治疗效果提供了新策略。
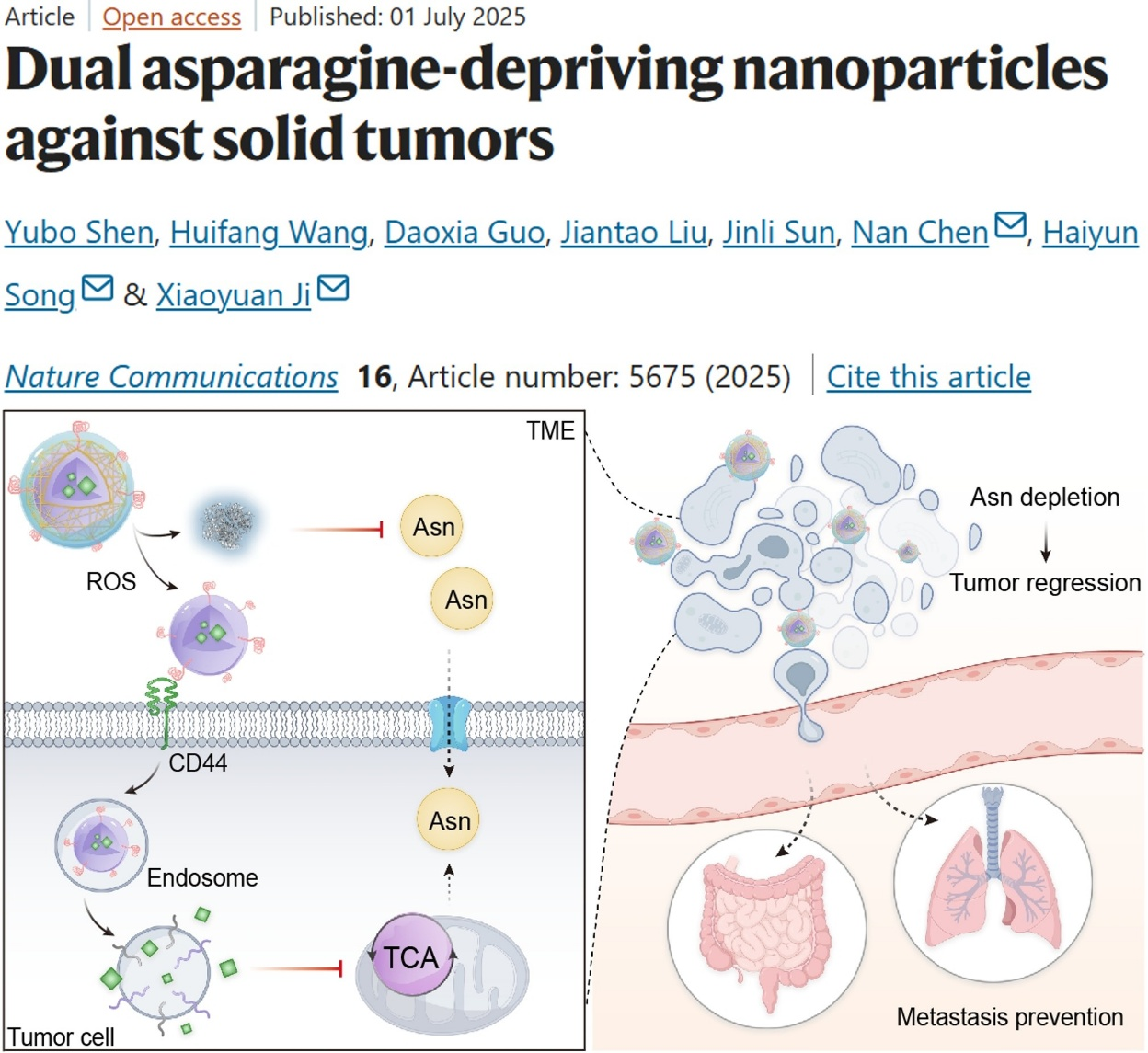
肿瘤的生长和转移过程高度依赖天冬酰胺代谢。目前,利用天冬酰胺酶 (ASNase)清除血液中的天冬酰胺已在白血病临床治疗中取得显著成效,但该疗法对实体肿瘤无效。研究发现,在营养匮乏条件下,实体肿瘤细胞能够通过代谢重编程来维持其增殖和存活能力。当外源性天冬酰胺供应不足时,实体肿瘤会显著上调天冬酰胺合成酶(ASNS)的表达,利用三羧酸循环(TCA)产生的天冬氨酸来合成内源性天冬酰胺,从而维持细胞内天冬酰胺的水平。为此,研究人员设计了一种具有可拆分核-壳结构的纳米粒子,通过同时装载ASNase和线粒体电子呼吸传递链复合物I抑制剂鱼藤酮(Rot),实现对肿瘤细胞外天冬酰胺摄取和细胞内天冬酰胺合成的双重阻断,克服实体肿瘤对单一ASNase治疗的适应性抵抗。该纳米粒子的内核为酸响应性聚己内酯-腙键-聚乙二醇(PCL-Hyd-PEG)纳米胶束,利用胶束的自组装特性在其疏水内核中负载了小分子抑制剂Rot,进一步在其表面修饰透明质酸(HA)用于靶向肿瘤细胞;可拆解外壳由肿瘤微环境响应性交联剂交联的ASNase构成。在肿瘤微环境中高水平活性氧的刺激下,纳米粒子的ASNase外壳结构解体,释放载带了Rot的纳米胶束和ASNase分子。其中,释放的游离ASNase分子负责水解微环境中的天冬酰胺;载带Rot的胶束内核特异性进入肿瘤细胞,在内涵体酸性条件下分解,释放Rot用于阻断天冬酰胺内源合成途径。
在原发三阴性乳腺癌小鼠模型中,天冬酰胺双重剥夺纳米粒子能够有效地富集于肿瘤部位,通过协同抑制肿瘤细胞对外源性天冬酰胺的摄取及其内源性合成,抑制肿瘤生长和远端转移。此外,在术后复发三阴性乳腺癌和结直肠癌小鼠模型中,天冬酰胺双重剥夺纳米粒子能抑制肿瘤术后复发及转移,并可诱导T细胞产生长期免疫记忆,有效防止肿瘤再次复发,展现出显著的治疗和免疫保护效应。这项研究发展了一种针对实体肿瘤的天冬酰胺双重调控技术,为肿瘤代谢疗法提供了新思路。
上海交通大学公共卫生学院宋海云研究员、季晓媛副研究员和上海师范大学化学与材料科学学院陈楠教授为该论文的共同通讯作者,上海交通大学硕士研究生沈钰博、直博生王慧芳为该论文的并列第一作者。该研究得到了国家重点研发计划、国家自然科学基金、上海市自然科学基金、上海市卫生健康委员会和中国博士后科学基金等项目的支持。
