哺乳动物细胞的自分泌(Autocrine)是调节细胞命运的重要方式。活化的T细胞是分泌能力强的效应细胞,它们可以通过分泌细胞因子杀死或调节靶细胞,同时也以自分泌的方式调节自身的增殖和分化。然而,活化的T细胞是否通过自分泌因子调节自身的细胞代谢和免疫反应尚不明确。8月15日,上海交通大学医学院贺兼理/王田实/程金科团队合作在美国临床研究学会出版的Journal of Clinical Investigation期刊上发表了题为"Autocrine VEGF-B signaling maintains lipid synthesis and mitochondrial fitness to support T cell immune responses"的最新成果,该研究发现的重要性是揭示了通过自分泌VEGF-B调控磷脂合成,维持线粒体膜稳态,促进活化T细胞的成活和免疫活性。

首先本研究通过筛选并结合高通量测序数据发现Vegfb基因的表达在TCR活化的T细胞中显著升高,并通过一系列实验证实T细胞活化后产生的VEGF-B因子可以通过自分泌的形成作用于自身。利用VEGF-B中和抗体以及T细胞中条件性敲除Vegfb或其受体Flt1基因的转基因小鼠,结合CD8+T细胞介导的抗感染与抗肿瘤以及CD4+T细胞介导的自身免疫等小鼠在体模型,本研究发现自分泌VEGF-B是维持T细胞存活与免疫反应的重要因子。
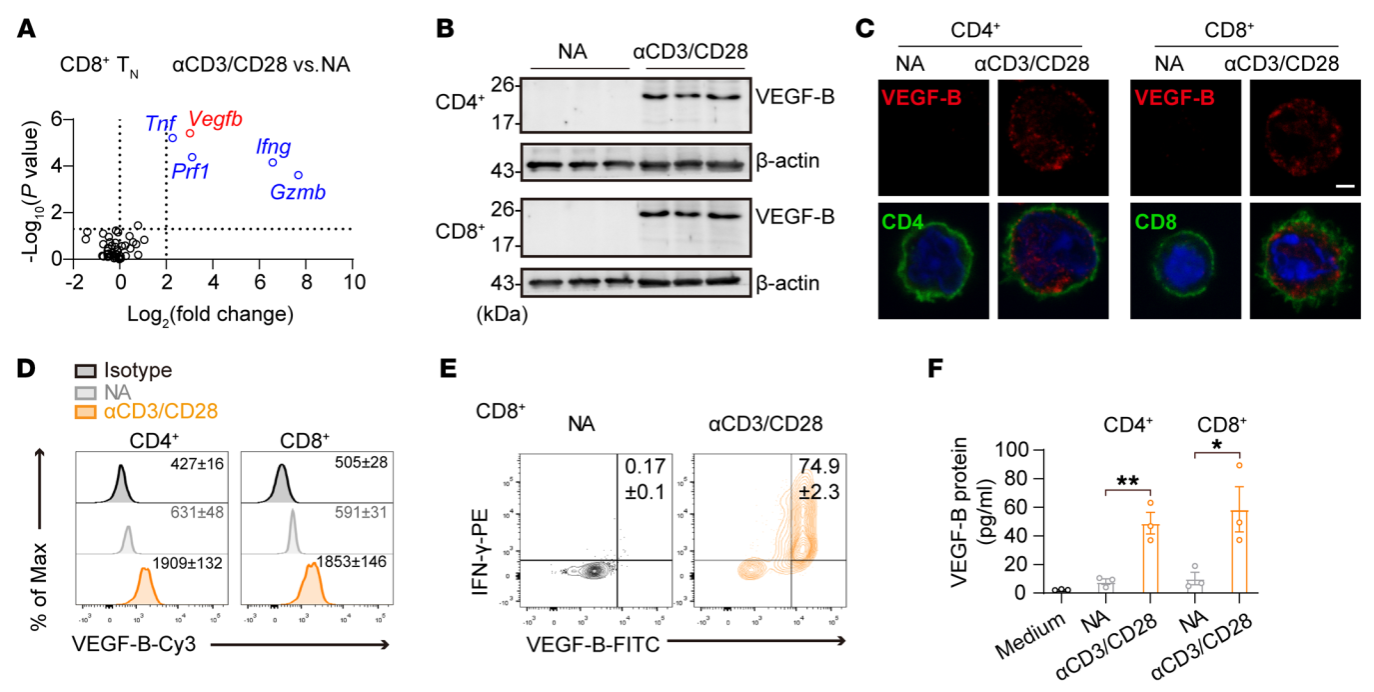
分子机制上,本研究通过RNA-seq高通量测序与脂质代谢组学以及ChIP-seq等数据分析,并结合透射电镜等技术手段,揭示了自分泌VEGF-B调节T细胞存活与线粒体适应性的信号途径。即:自分泌VEGF-B通过与T细胞上表达的受体结合激活转录因子GABPα,并诱导SENP2蛋白的表达,SENP2通过去SUMO化修饰激活PPARγ,介导了活化T细胞中的脂质合成。线粒体内膜中的心磷脂作为细胞色素c的锚点,可以启动线粒体凋亡。
本研究同时证实在人类T细胞中同样存在TCR活化后自分泌VEGF-B并维持T细胞存活与线粒体稳态的现象。系统性红斑狼疮(SLE)是一种严重的自身免疫性炎症性疾病,CD4+ T细胞的异常活化在SLE的发病机制中起主导作用,本研究检测了从SLE患者与健康志愿者血液样本中分离的CD4+ T细胞,结果显示SLE患者血液CD4+ T细胞中VEGFB和FLT1的表达增加。同时,通过分析ImmuNexUT与GEO database发现在多种自身免疫疾病异常活化的T细胞中VEGFB和FLT1的表达均显著增加。结合EAE与DSS小鼠自身免疫模型,本研究证实自分泌VEGF-B信号是T细胞介导的自身免疫性疾病所必需的因子。针对VEGF-B信号的干预可能为过度活跃的炎性T细胞驱动的自身免疫性疾病提供潜在的治疗方法。
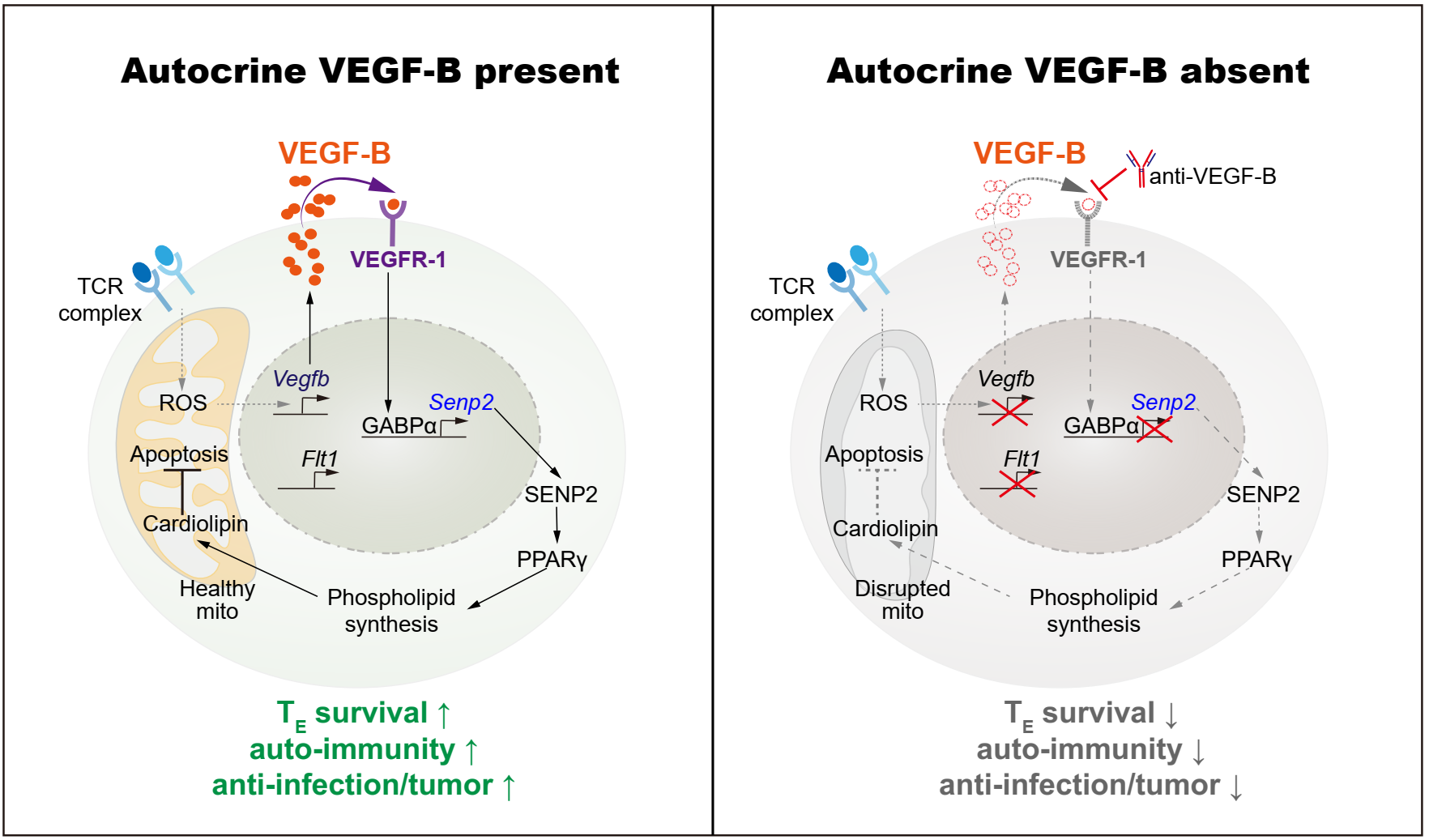
此外,本研究发现自分泌VEGF-B是通过ROS依赖的方式在活化的T细胞中被诱导产生的。根据以往的报道,线粒体ROS的产生是抗原特异性T细胞反应所必需的,在TCR活化初始阶段,较低水平的ROS是介导了T细胞的早期活化与增殖,而ROS通常在T细胞活化的后期积累到高水平并介导T细胞的线粒体损伤与凋亡。本研究报告了ROS通过触发自分泌VEGF-B信号传导来减少活化T细胞的凋亡。这一发现表明ROS启动的自分泌VEGF-B信号为T细胞在TCR刺激下的扩增提供了另一种支持,即通过调节的线粒体适应性维持T细胞活化后的存活与免疫应答。因此,本研究同时丰富了ROS信号在免疫应答中通过调节自分泌因子重塑细胞代谢模式并介导细胞存活的生物学作用。
本研究由上海交通大学医学院贺兼理/王田实/程金科团队合作完成,基础医学院贺兼理副研究员为本文的第一作者兼通讯作者,王田实副研究员和程金科教授为本文的共同通讯作者,基础医学院陈亚兰助理研究员、附属仁济医院风湿科丁慧华副主任医师和公共卫生学院周金安实验师为本文的共同第一作者。本项目受到了附属仁济医院风湿科的沈南教授和上海交通大学药学院邓刘福教授的大力支持。
