上海交通大学医学院-国家热带病研究中心全球健康学院郭晓奎教授团队,依托国家重点研发计划“中国和英国政府间流行病预防与抗微生物耐药性“大健康”旗舰挑战计划项目——基于全健康的中英细菌耐药动态变化规律及驱动因素研究”,在崇明岛针对鸻鹬类候鸟开展了微生物耐药性(AMR)监测工作。近日,该团队的研究成果在国际生态学权威期刊 Environment International 上在线发表,首次从分子流行病学角度揭示了东亚-澳大利西亚迁徙候鸟中三代头孢菌素耐药性肠杆菌(3GCRE)的传播特性及其关键耐药质粒溯源。

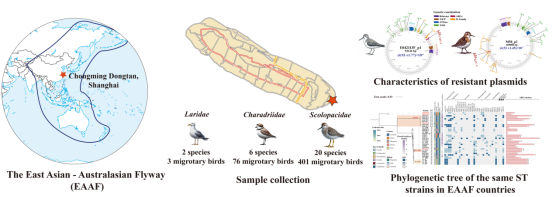
在全球抗菌药物耐药性问题日益严峻的背景下,候鸟由于其长距离迁徙特性,不仅成为生态系统中耐药菌传播的“受害者”,同时也充当着耐药基因的“扩散器”。本研究以东亚-澳大利亚迁徙路线(EAAF)为切入点,通过对候鸟体内耐药菌的监测与基因组追踪,旨在揭示耐药质粒的跨物种、跨区域传播机制,为全球AMR防控与生态安全提供科学依据。
上海交通大学医学院-国家热带病研究中心全球健康学院基于交大崇明校区的建设,依托崇明岛丰富的湿地生态资源,与英国爱丁堡大学携手,在“全健康”(One Health)理念指导下,针对候鸟-人类-环境交汇的复杂网络,开展了耐药菌动态变化规律及驱动因素的对比研究。本项目为中英在细菌耐药性研究领域搭建了国际合作新平台,旨在通过跨学科、跨国界的合作,共同构建生态、动物与人群联防联控的耐药防控体系。
本研究在2023年春秋两季候鸟迁徙期间,于上海崇明东滩国家级自然保护区内,对28个鸻鹬类候鸟种类共480只进行了现场采样,总计获得893份咽拭子和泄殖腔拭子样本,并从中分离出6株耐三代头孢菌素的肠杆菌,其中包括:4株肠外致病性大肠埃希菌(其中1株来自大滨鹬、1株来自翘嘴鹬、2株来自环颈鸻)和2株肺炎克雷伯菌(分别来源于长趾滨鹬与尖尾滨鹬)。
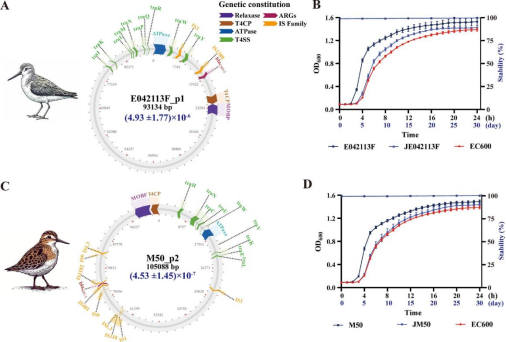
研究团队采用二代和三代高通量测序平台,对从候鸟体内分离出的耐药菌株进行全基因组测序,重点解析耐药质粒的结构及其携带的耐药基因。聚焦于两种关键的接合性耐药质粒:1. E042113F_p1质粒:源自大肠埃希菌,携带关键耐药基因 blaCMY-2; 2. M50_p2质粒:源自耐碳青霉烯肺炎克雷伯菌,携带关键耐药基因 blaKPC-2。实验结果显示,这两种质粒在转移至不同宿主菌过程中几乎不产生适应性代价,并能稳定传代超过30次,表明其在环境中的扩散能力极强。
研究人员结合NCBI公开数据库中来自EAAF迁徙路线各国鸟类分离到的大肠埃希菌与肺炎克雷伯菌数据,构建了一个全面的基因组数据库,对耐药质粒的分布与演化进行了跨国比对。通过基因组信息追踪及系统进化树构建,研究发现,与E042113F_p1质粒相似的耐药载体最早于2015年在中国燕子体内被检测到,随后在2017年蒙古、2018年俄罗斯和2019年澳大利亚的野生候鸟中陆续出现。分析结果显示,这两种质粒最早均可能来源于人类,提示耐药质粒很可能由人类逐步传播到动物体内,并通过候鸟迁徙途径实现跨区域、跨国界的扩散。进一步的分子结构解析表明,ISEcp1在blaCMY-2基因附近的存在,以及tnpr-ISKpn27-blaKPC-2-ISKpn6的复合结构,在重塑质粒结构及促进耐药基因在质粒间传播中发挥了关键作用,这为理解耐药性在细菌间的迅速扩散提供了重要分子机制依据。
本研究表明,长途迁徙的鸟类活动对 AMR 的传播和扩散构成了重大风险,警示生态系统、动物健康及公共卫生安全均可能受到严重影响。基因组追踪与系统进化分析显示,两种关键耐药质粒最早可能来源于人类,表明人类抗菌药物滥用与环境污染可能为耐药基因跨物种传播提供“启动器”。因此,加强抗菌药物管理、改善环境卫生条件及构建基于“全健康”理念的防控体系已迫在眉睫。
上海交通大学医学院-国家热带病研究中心全球健康学院博士研究生程子乐、硕士研究生陈祎雯和实验师李敏为本文的共同第一作者,全球健康学院朱泳璋副教授、郭晓奎教授和中国医学科学院医学生物学研究所姚宇峰教授为本文的共同通讯作者。本研究得到国家重点研发计划(No.2024YFE0199000)、国家自然科学基金项目(No.32170141)、云南省“兴滇英才支持计划”(XDYC-CYCX-2023-0074)和美国中华医学基金会(No.20-365)等基金的支持。
全文链接:https://doi.org/10.1016/j.envint.2025.109320
