11月4日,上海交通大学公共卫生学院刘宁宁/王慧联合中国科学院计算技术研究所赵屹、同济大学附属东方医院吴文娟、上海交通大学医学院附属仁济医院丁慧、南京医科大学附属无锡人民医院毛文君等团队在国际领域知名期刊iMeta在线发表题为“The interplay between tissue-resident microbiome and host proteins by integrated multi-omics during progression of colorectal adenoma to carcinoma”的研究论文。该研究整合深度宏基因组与蛋白质组学数据,系统揭示了结直肠腺瘤-癌演进过程中组织驻留多界微生物组与宿主蛋白质组的动态互作网络,并基于此构建了高精度诊断模型,为结直肠癌的早期筛查和靶向干预提供了新靶点和新策略。

结直肠癌(Colorectal Cancer, CRC)是全球第三大常见癌症,也是我国发病率和死亡率持续上升的重大公共健康问题。结直肠腺瘤是CRC的主要癌前病变,其恶变预测与干预仍是临床痛点。近年来,“多形态微生物组”被列为癌症的新标志,促进了人类对癌症认知的重大突破。肿瘤内微生物组作为肿瘤微环境的重要组成部分,其与宿主细胞间的相互作用对癌症的发生、发展及治疗响应具有关键影响。然而,肿瘤内微生物组的异质性、潜在来源、组织特异性富集以及与宿主信号通路的互作机制尚不清楚。本研究通过整合深度宏基因组与蛋白质组学多组学数据,系统解析了结直肠癌从腺瘤到癌的演进过程中的四界微生物—宿主互作网络,揭示了驱动癌变的关键生物机制,为中国人群结直肠癌精准筛查与防治提供理论基础。
本研究构建了结直肠癌组织驻留多界微生物生态网络,对来自185份结直肠组织样本(腺瘤、癌及癌旁组织)的宏基因组和蛋白质组进行了联合分析,共鉴定出4057种细菌、61种真菌、108种古菌及374种病毒。结果揭示出CRC组织中存在独特的多界微生物互作网络,构成一个以细菌–真菌–古菌–病毒–免疫细胞为核心的生态系统;通过蛋白质组聚类分析,研究发现CRC特异的微生物-宿主互作模式与分子亚型,CRC可分为四个亚型(C1–C4),每种亚型均具有不同的分子特征与临床预后。进一步分析发现,肿瘤内微生物组与宿主蛋白的互作具有显著的动态重组特征:不同微生物通过不同蛋白通路作用于共同信号节点,参与调控免疫应答、细胞增殖与代谢重编程。研究团队首次在CRC组织中识别出三个特征性真菌分型,揭示真菌在癌变进程中的核心调控作用。这一发现拓展了对“真菌—宿主互作”在肿瘤发生中功能的理解,阐明了真菌在肿瘤微生态中的关键作用;基于多组学特征,研究确定了14个微生物与8个宿主蛋白的组合标志物,可高精度区分腺瘤与癌(AUROC = 0.962),并在外部验证集中表现稳定。此外,以8个微生物与4个蛋白构建的模型可准确区分早期与晚期CRC(AUROC = 0.926),显示出在临床转化与早筛中的巨大潜力;利用患者来源类器官与结直肠癌同种移植小鼠模型,研究发现产肠毒素Bacteroides fragilis和Fusobacterium nucleatum可通过激活Wnt/β-catenin与NF-κB信号通路促进肿瘤进展,证实了微生物–宿主互作在结直肠癌演进中的关键致癌机制。
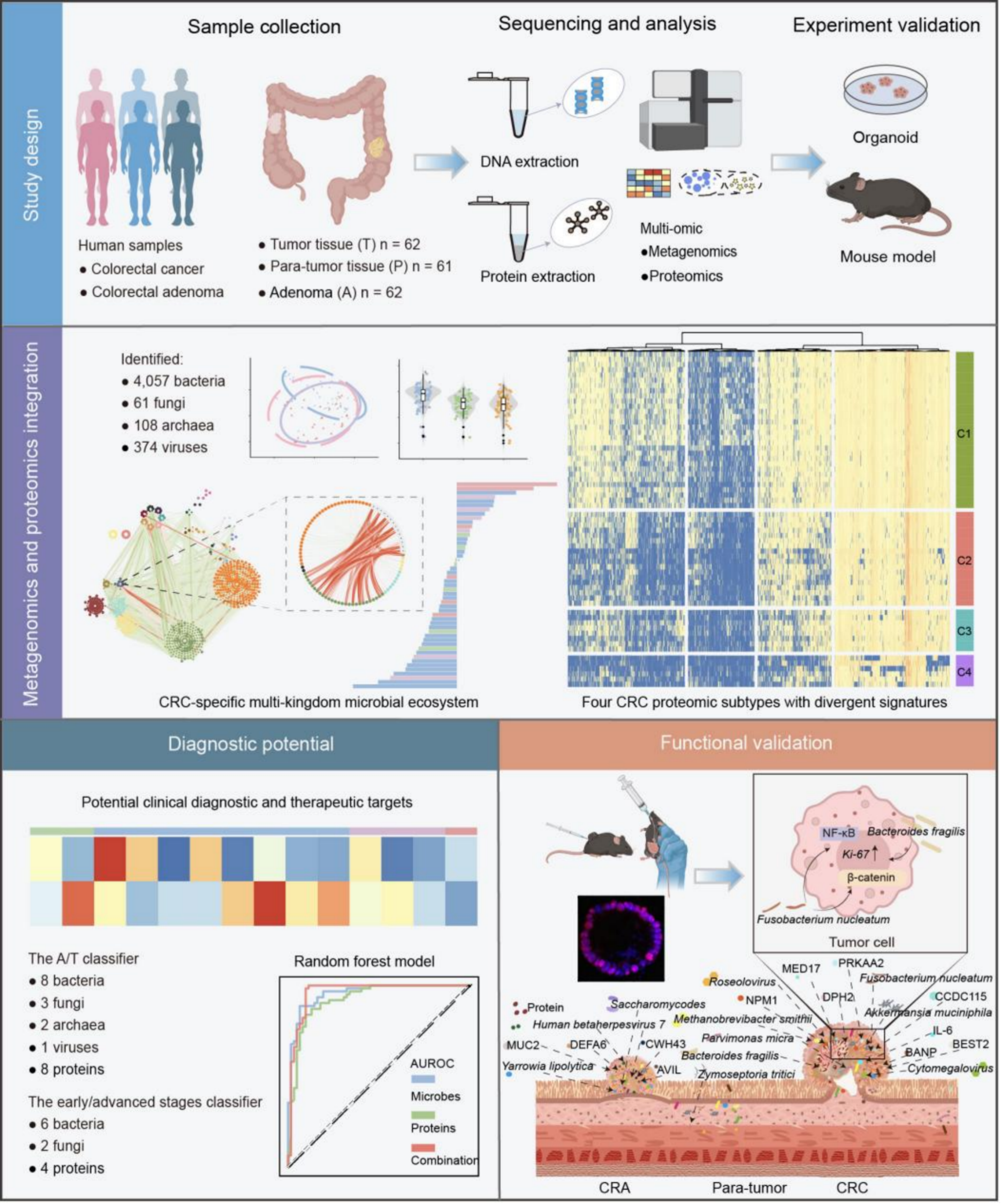
该研究首次在蛋白质水平系统解析了CRC演进过程中组织驻留微生物–宿主蛋白互作的动态网络,揭示了肿瘤微生态对癌变驱动的复杂调控机制。研究成果不仅深化了对“腺瘤—癌”转化分子过程的理解,也为结直肠癌精准诊断、生物标志物发现和靶向干预策略提供了新思路与新靶点。未来,该研究提出的多界微生物组–宿主互作模型,有望成为癌症多组学分析与干预研究的新范式,为推动微生物–宿主互作的精准医学应用提供技术路径。
本研究第一作者为上海交通大学公共卫生学院吴迪、上海交通大学公共卫生学院和上海市徐汇区疾病预防控制中心王安君、中国科学院计算技术研究所卜德超、上海交通大学公共卫生学院孙彦彦和中国科学院计算技术研究所李晨昊,通讯作者为上海交通大学公共卫生学院刘宁宁研究员、王慧教授、中国科学院计算技术研究所赵屹研究员、同济大学附属东方医院吴文娟教授、上海交通大学医学院附属仁济医院丁慧主治医师和南京医科大学附属无锡人民医院毛文君副教授。该研究还得到了中国科学院大学杭州高等研究院和复旦大学基础医学院陈剑峰教授、上海交通大学医学院附属仁济医院俞旻皓副主任医师、贺薇主治医师和徐佳主任医师的大力支持。研究获得国家自然科学基金、国家重点研发计划及上海市科委等项目资助。
