阿尔茨海默病(Alzheimer’s disease, AD)是最常见的神经退行性疾病之一,也是全球主要致死原因之一。传统上,AD 的病理特征主要包括脑内异常的淀粉样蛋白(Aβ)斑块和 tau 蛋白缠结。然而,越来越多的研究表明,神经炎症在 AD 的发生发展中同样起着关键作用。在疾病过程中,小胶质细胞长期处于活化状态,并与 Aβ 斑块相互作用,呈现多样化的功能表型。值得关注的是,小胶质细胞中的脂滴积聚与衰老及神经退行性病变密切相关,可诱导过量活性氧(ROS)及促炎因子生成,加重脑内炎症反应。但脂滴在小胶质细胞中的异常积累原因及其对 AD 病理过程的具体影响机制仍未得到充分阐明。
针对这一关键科学问题,上海交通大学医学院附属第一人民医院王宏林课题组从中药来源的活性分子入手,围绕天然三萜类化合物AKBA(乙酰-11-酮-β-乳香酸)通过化学修饰合成了大量衍生分子,最终筛选出抑制免疫细胞促炎型分化效果最显著的化合物 - CKBA并展开机制探索,发现其具备优异的血脑屏障通透性和靶向神经炎症作用能力。该研究成果于2025年10月29日发表于国际知名学术期刊Nature Aging上题为“Loss of MFE-2 impairs microglial lipid homeostasis and drives neuroinflammation in Alzheimer’s pathogenesis”。

研究团队通过系统的分子、细胞及动物模型研究,发现过氧化物酶体脂肪酸β-氧化关键酶 MFE-2 是调控小胶质细胞脂质代谢稳态与神经炎症反应的核心节点。在阿尔茨海默病患者及模型动物中,MFE-2 表达显著下降,导致脂质过度积聚、花生四烯酸及氧化应激水平升高,从而驱动小胶质细胞持续活化并加剧Aβ沉积。研究进一步鉴定出天然化合物衍生物3-O-cyclohexane carbonyl-11-keto-β-boswellic acid(CKBA)可高亲和力结合并上调 MFE-2,显著改善神经炎症与病理损伤。
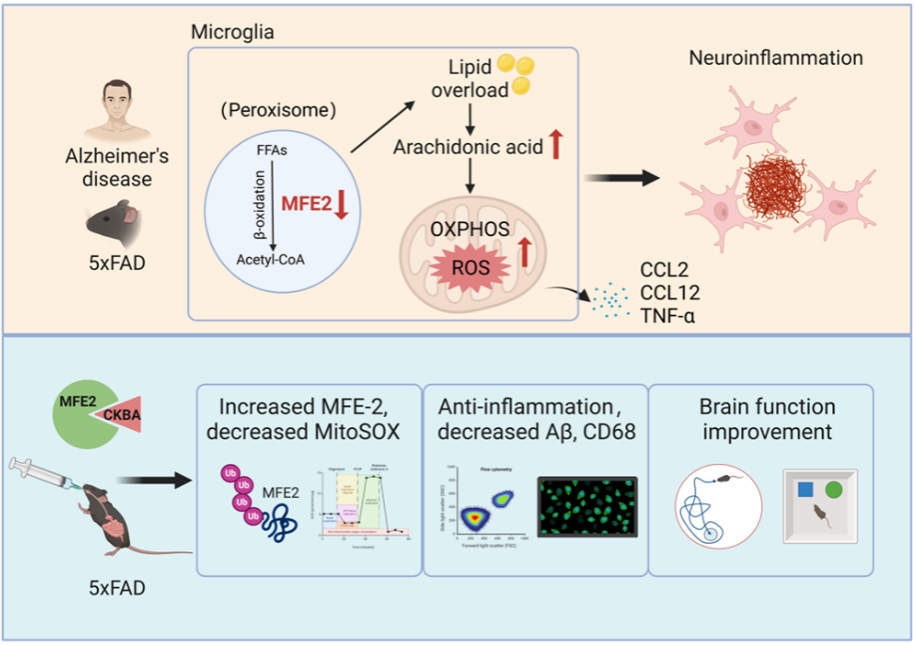
该研究不仅系统揭示了阿尔茨海默病早期“代谢 - 炎症”耦合通路的关键靶点,也提出了基于天然产物结构优化的靶向小分子候选药物,展示了从机制研究到转化应用的完整科研链条,随着 CKBA 分子的进一步改造、优化与临床前评价推进,未来有望为全球阿尔茨海默病防治提供新的治疗思路与干预策略。
本研究受到国家自然科学基金原创探索计划(82450903)、上海市“科技创新行动计划”实验动物研究项目(22140903100)、国家自然科学基金(82073428, 82471773)和中国博士后面上基金(2021M692114,No. GZB20230431, and No. 2023M742313)的支持。
