近日,著名学术期刊Advanced Materials在线发表了上海交通大学公共卫生学院宋海云研究员、季晓媛副研究员和上海师范大学化学与材料科学院陈楠教授团队题为“Dismantlable Coronated Nanoparticles for Coupling the Induction and Perception of Immunogenic Cell Death”的研究成果。该研究设计和构建了一种可拆分的、具有核-壳结构的抗体冠化纳米粒子,在肿瘤微环境中通过核-壳分离,分别作用于肿瘤细胞内部和肿瘤相关树突状细胞表面,将免疫原性细胞死亡信号的产生与免疫感应偶联,协同触发先天性和适应性免疫,进一步增强肿瘤对免疫检查点疗法的敏感性,为肿瘤的化学与免疫联合疗法提供了一种新方案。
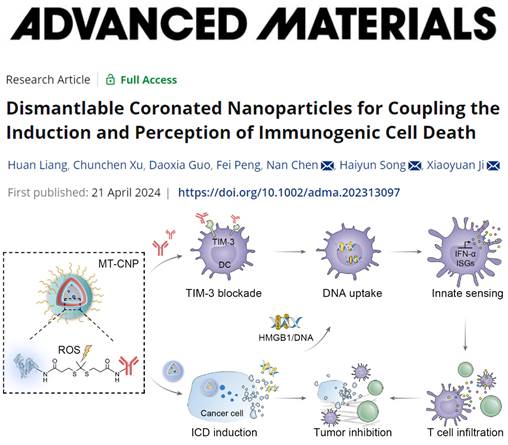
图1 可拆分抗体冠化纳米粒子介导的癌症联合治疗策略示意图。
图片来源:Adv. Mater.
免疫原性细胞死亡(ICD)在肿瘤免疫治疗中扮演着不可或缺的角色:肿瘤细胞受到外界压力刺激发生死亡时产生并释放多种免疫信号分子,这些信号分子能够被树突状细胞(DCs)感知进而激活机体免疫反应。然而,DCs表面高表达的T细胞免疫球蛋白和粘蛋白结构域-3(TIM-3)将ICD信号隔离在DC细胞表面,严重妨碍了DCs对ICD的感知。研究人员利用装载ICD诱导剂米托蒽醌(MTO)的介孔硅纳米粒子作为抗体冠化纳米粒子的内核,肿瘤微环境响应性交联剂交联的TIM-3抗体(αTIM-3)构成抗体冠化纳米粒子的可拆解外壳,并进一步偶联肿瘤新生血管靶向肽赋予抗体冠化纳米粒子靶向肿瘤组织的能力。在肿瘤微环境中高水平活性氧的刺激下,该纳米粒子的冠状结构解体,释放载带了ICD诱导剂的介孔硅纳米粒子和αTIM-3分子。其中,载带ICD诱导剂的纳米粒子内核能够被肿瘤细胞内化,增强ICD,并释放多种ICD信号分子;释放的游离αTIM-3分子阻断DCs表面的TIM-3,增强其对ICD信号分子的感知能力,促进DCs成熟,激活T细胞免疫反应,协同抑制肿瘤生长(图1)。
在三阴性乳腺癌和结直肠癌小鼠模型中,包被肿瘤新生血管靶向肽的纳米粒子能够更有效地富集于肿瘤部位,通过同时增强肿瘤细胞内ICD和阻断DC表面TIM-3,协同触发先天性和适应性免疫以抑制肿瘤的发展进程。此外,研究发现抗体冠化纳米粒子可增强小鼠三阴性乳腺癌和结直肠癌对aPD-1的药物敏感性并显著延长小鼠生存时间。这项研究提出了一种借助可拆分抗体冠化纳米粒子实现肿瘤细胞杀伤作用与免疫感应紧密偶联的策略,为肿瘤联合疗法提供了一种新思路和方法。
上海交通大学公共卫生学院宋海云研究员、季晓媛副研究员和上海师范大学化学与材料科学院陈楠教授为该文的共同通讯作者。上海交通大学硕士研究生梁欢、徐春辰和博士研究生郭道霞为该论文的并列第一作者。
