STING(Stimulator of interferon genes,干扰素基因刺激因子)是天然免疫过程中的重要调控分子,cGAS-STING通路可感知游离DNA并激活下游NF-κB和IRF3信号分子,产生Ⅰ型干扰素,对感染,自体免疫疾病,炎症反应及细胞衰老等过程均有重要作用 【1-5】。近年的研究也显示STING介导了游离DNA或cGMAP引起的非经典自噬过程,该过程往往不需要经典自噬分子如ULK1复合物或VPS34-Beclin1复合物的参与【6,7】。然而,目前对于STING在能量缺失诱导的经典自噬通路中的功能仍不明确。
5月5日,上海交通大学医学院病理生理学系钟清、留筱厦课题组联合华中科技大学同济医学院病原生物学系荣岳光课题组及美国德州大学西南医学中心Helmut Kramer团队在国际知名期刊Journal of Cell Biology上发表了题为STING controls energy stress-induced autophagy and energy metabolism via STX17的研究论文。在本研究中,研究者利用果蝇,小鼠和培养细胞体系,深入揭示了STING分子的激活可负调控能量缺失引起的自噬过程,其机制为STING可通过与自噬膜融合重要蛋白STX17结合,影响STX17蛋白从内质网运输到完整自噬体的转运过程,从而抑制自噬体-溶酶体融合效率并下调细胞自噬。该研究为揭示STING分子的非免疫功能,及其与自噬和能量代谢的关系提供了新的思路。

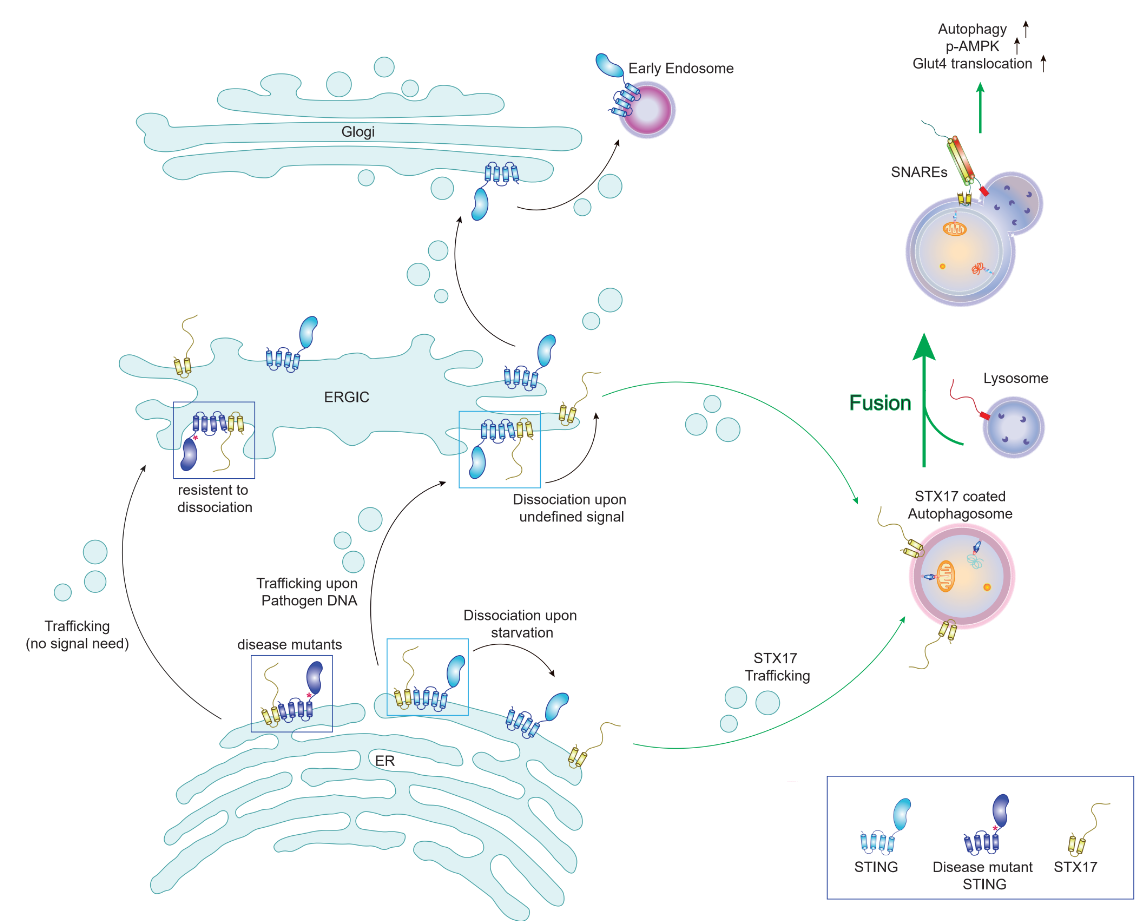
首先,研究团队通过对缺失STING的果蝇脂肪体细胞(fat body cells)中的自噬表型进行分析,发现STING的缺失可引起自噬通量升高,自噬体与溶酶体融合速率加快,且通过对自噬膜融合关键分子STX17的双重敲除实验推断STING缺失引起的自噬通量增加极有可能是通过STX17发挥作用。随后,研究者利用小鼠运动模型再次证明,在STING敲除的小鼠中,急性运动引起的自噬水平升高,自噬底物降解加剧,且运动引起的能量代谢关键分子AMPK(Adenosine 5‘-monophosphate (AMP)-activated protein kinase)激活水平增加。通过进一步对AMPK分子底物激活的分析的和糖,脂代谢指标的检测,证明STING缺失可能通过上调运动刺激下骨骼肌中AMPK活性,从而增加其下游TBC1D1(TBC1 Domain Family Member 1)分子磷酸化水平及其所调控的葡萄糖转运分子GLUT4(Glucose transporter type 4)向骨骼肌细胞质膜上的转运过程,导致STING敲除小鼠骨骼肌细胞对血液中葡萄糖分子摄取水平显著提升,运动能力增强。而STING的缺失并没有影响到急性运动模型中小鼠体内脂肪的代谢水平。该部分实验创新性地提出了STING对于自噬的负调控功能和对机体能量代谢的影响,那么在分子机制上STING又是怎样作用于自噬过程的呢?接下来,研究者通过对STING缺失细胞的研究发现,STING缺失可加速能量缺失诱导的自噬中的自噬体-溶酶体融合过程,且该功能依赖于经典自噬途径的调控蛋白,如STX17, ULK1/2, ATG14, ATG9A ATG5等。进一步的分子机制研究显示,驻留于内质网的STING分子可直接结合自噬膜融合关键蛋白复合体SNAREs中的重要成分STX17蛋白,阻止其转运至自噬体上,抑制了与SNAP29, VAMP8组装成自噬SNARE复合物的过程。且STING-STX17之间的相互作用可被能量缺失干扰,证明饥饿引起的自噬确是通过STING-STX17在内质网上的相互作用控制自噬膜融合效率。
另外,近年对STX17的研究发现该分子不仅介导了自噬膜融合,也由于TBK1(TANK-binding kinase 1)对其的磷酸化,参与了自噬体初始结构mPAS的形成过程【8】,那么STING-STX17相互作用是否影响了mPAS的形成呢?研究者发现被TBK1磷酸化后的STX17 pS202并不能与STING结合,并且更多地分布于DFCP1(Double FYVE-containing protein 1)标记的初始自噬体结构;相反的,S202位点磷酸化失活形式的STX17则表现出与STING较好的相互作用,且分布于LC3+-LAMP2+(Lysosome-associated membrane glycoprotein 2)标记的完整自噬体结构。该部分实验指出STING可能作用于未被TBK1磷酸化的STX17蛋白,从而特异性地影响自噬体-溶酶体融合,而不作用于自噬体形成阶段。接下来,研究者探究了STING-STX17相互作用是否会被cGAMP导致的STING激活水平影响。研究者发现STING-STX17的解离会发生于cGAMP激活STING分子或STING分子发生ER-ERGIC转运后,且与疾病相关的STING过激活形式表现出与STX17相互作用的增强及对自噬的抑制。并且,研究者发现STING C148位点是与STX17结合的关键作用位点,在敲除细胞中回补STING C148位点的失活突变形式表现出了较弱的自噬抑制功能。该部分证明了STING的激活干扰了其与STX17的结合,且揭示了STING-STX17相互作用的生化机制。
最后,研究者发现,STING-STX17作用轴与STING分子本身在PAMPs诱导的非经典自噬途径中是相互独立的,表现为HT-DNA诱导下STX17与STING解离后分布于不同的自噬相关结构,且STX17的敲除不影响STING分子的降解和转运过程。
本研究表明,在营养充足和先天免疫未被激活的环境中,STING分子可通过与自噬膜融合重要蛋白STX17结合,使其驻留在内质网中,从而抑制了STX17参与的自噬体-溶酶体融合过程,下调了自噬通量。在STING缺失,或被cGAMP激活,及发生内质网-ERGIC转运时,STX17被STING释放,导致自噬水平上调,从而增强了运动状态下机体糖代谢水平和运动能力。总之,该研究揭示了全新的STING非免疫功能,即对能量缺失引起的经典自噬通路的空间调控作用,提示了先天免疫与能量代谢之间的新关联。
华中科技大学同济医学院荣岳光教授,上海交通大学医学院助理研究员张燊博士,德州大学西南医学中心Nilay Nandi博士以及华中科技大学同济医学院博士研究生吴哲为该论文的共同第一作者,上海交通大学医学院钟清研究员,华中科技大学同济医学院荣岳光教授,德州大学西南医学中心Helmut Kramer教授及上海交通大学医学院留筱厦副研究员为该论文的共同通讯作者。
