近日,上海交通大学公共卫生学院/单细胞组学与疾病研究中心王慧/李晓光/李辰团队合作在国际知名综合性期刊Advanced Science在线发表了题为“Spatio-Temporal Proteomic Landscape Reveals Early Warning Signals of Esophageal Squamous Cell Carcinoma Progression”的研究论文。该研究通过基于激光捕获显微切割(LCM)技术的空间分辨蛋白质组学方法构建了食管鳞状细胞癌(ESCC)早期发生进展的时空蛋白质组学图谱,涵盖了炎症、鳞状上皮异型增生和鳞癌等多个关键阶段。基于组学数据分析、临床样本验证和体内外功能学实验,该研究系统揭示了ESCC早期发生进展过程中的关键蛋白质变化并发现中度异型增生阶段可作为早期干预窗口期,筛选并验证了七种关键的早期预警生物标志物,同时提出了靶向PARP1-TP63-GBP6轴的早期干预新策略,为ESCC的早期诊断、随访监测及早期干预提供了重要科学依据。

食管癌是全球范围内常见的上消化道恶性肿瘤之一,根据组织类型主要分为食管鳞状细胞癌(ESCC)和食管腺癌(EAC),在我国尤以ESCC为主。ESCC早期缺乏特异性临床症状和体征,大部分患者在接受治疗时已达中晚期,导致总体预后不佳。早诊早治是改善患者预后,降低疾病负担的有效举措,这进一步凸显了在肿瘤发生进展过程中探索预警生物标志物和早期干预靶点的重要性。蛋白质组学技术是解析肿瘤生物学机制、探索生物标志物和挖掘分子靶点的有效手段,但目前仍缺乏针对ESCC早期发生进展过程的综合性蛋白质组学研究。一方面是由于活检来源的临床样本不易获得且体积较小,在满足临床诊断的前提下获得足够的活检组织进行蛋白质组学研究仍面临一定挑战;另一方面是由于处于癌前病变阶段的活检组织中大部分区域仍旧为正常上皮组织,仅有小部分是真正的病变区域,如果使用传统的蛋白质组学方法直接进行分析,则获得的组学数据无法准确反映病变区域的分子特征。
因此,基于上述问题,研究人员通过基于激光捕获显微切割(LCM)技术的空间分辨蛋白质组学方法,利用食管上皮活检组织构建了ESCC早期发生进展的多阶段蛋白质组学图谱,涵盖了炎症、上皮异型增生以及鳞癌等多个关键阶段的上皮病变组织与邻近的非病变组织,为探索ESCC的早期发生进展提供了宝贵的蛋白质组学数据资源。
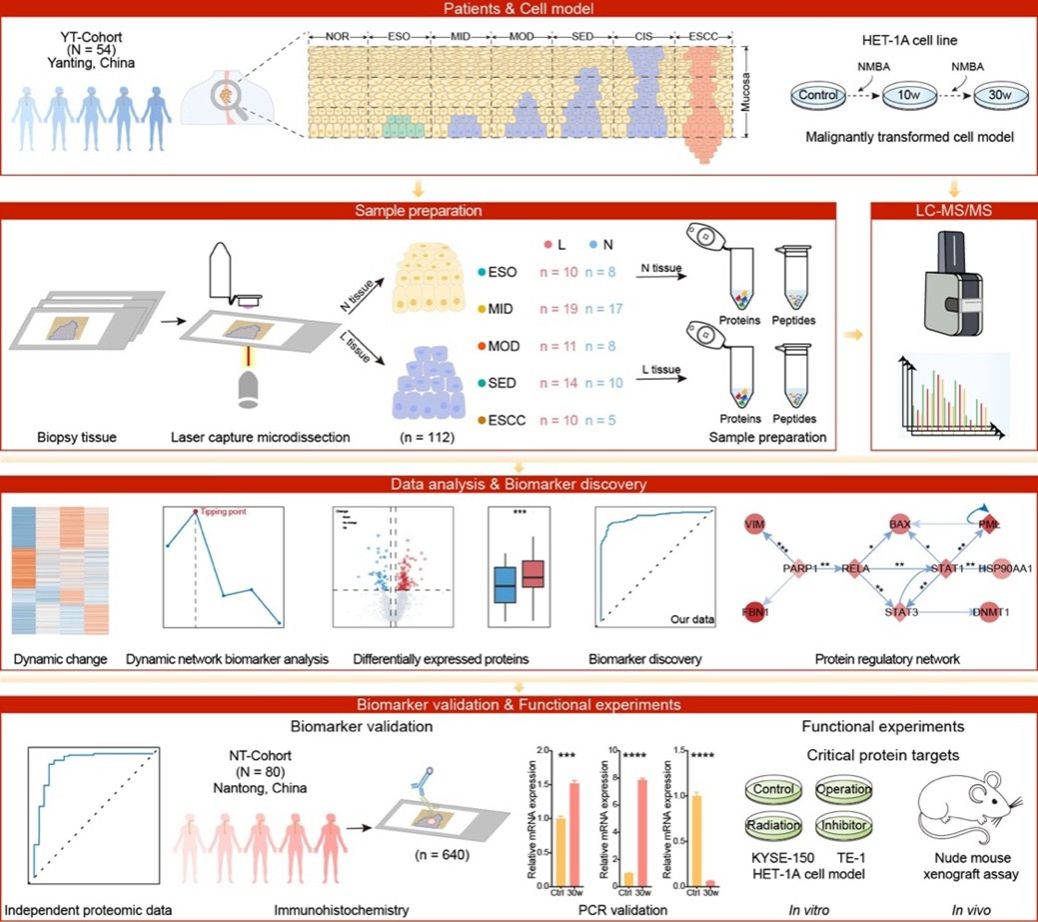
图1. 食管鳞癌发生进展的蛋白质组学图谱与早期预警生物标志物研究
研究人员首先通过组学数据分析系统揭示了ESCC早期发生进展过程中蛋白质的非线性变化,发现早至轻、中度异型增生阶段就已经存在食管上皮功能特性的显著丢失和致癌生物学事件的明显激活;动态网络生物标志物(DNB)分析表明中度异型增生是进展过程中的关键转折阶段,提示可作为早期干预窗口期;通过构建机器学习模型和整合外部临床组织样本筛选并验证了七种早期预警生物标志物(CCDC86,GBP6,PDCD6IP,C19orf53,SF3A3,GMPPB,ARPC5);随后,研究人员通过构建恶性转化的人食管上皮细胞模型并利用ESCC细胞系、小鼠动物模型等证实食管组织中富集的蛋白质GBP6可作为ESCC的早期干预靶点,机制研究表明DNA损伤诱导的GBP6丢失可通过调控细胞周期和诱导上皮-间充质转化促进ESCC进展,同时发现靶向PARP1可通过抑制TP63以逆转GBP6丢失,进而抑制ESCC。总之,该研究为解析食管上皮癌前病变的发生进展机制提供了丰富的蛋白质组学数据资源,也为食管鳞癌的防治关口前移和早期预警干预提供了重要科学依据。
上海交通大学公共卫生学院/单细胞组学与疾病研究中心王慧教授、李晓光研究员、李辰研究员和盐亭肿瘤医院李军为本文的通讯作者。上海交通大学公共卫生学院/单细胞组学与疾病研究中心博士后李旭苗、2022级直博生袁婕、高敏博士和南通市肿瘤医院刘继斌博士为本文共同第一作者。该研究得到国家重点研发计划、国家自然科学基金、上海市自然科学基金等项目的支持。
