2026年1月19日,上海交通大学医学院洪登礼团队在Vita杂志发表题为“Is there a common developmental mechanism underlying childhood cancers?”的观点文章(Expert Views),从发育生物学视角提出儿童肿瘤的共同起源机制。
儿童肿瘤起源于胎儿和婴儿期发育过程中,且高频发生于造血系统和神经系统。学者多认为儿童肿瘤的起源与发育过程中组织干细胞的增殖和分化有关。但三个胚层的所有组织干细胞都需要增殖与分化,这难以解释儿童肿瘤选择性地在某些系统高频发生的现象。团队前期发表在Nature的研究发现:儿童白血病的起源与造血系统的发育密切相关。基于此,团队提出:儿童肿瘤发生的“偏好性”很可能和系统的发育特征密切相关。
文章比较了造血系统与神经系统发育过程,指出两者的早期发育具有若干共同特征(图1):第一,血细胞要流经身体每一处组织,神经纤维需要伸及每一个器官组织;第二,造血发育涉及多个组织器官,神经发育形成多处、多个器官的神经组织;第三,造血干祖细胞和神经干祖细胞在原位生成后,需要在多处多个器官组织间迁移。
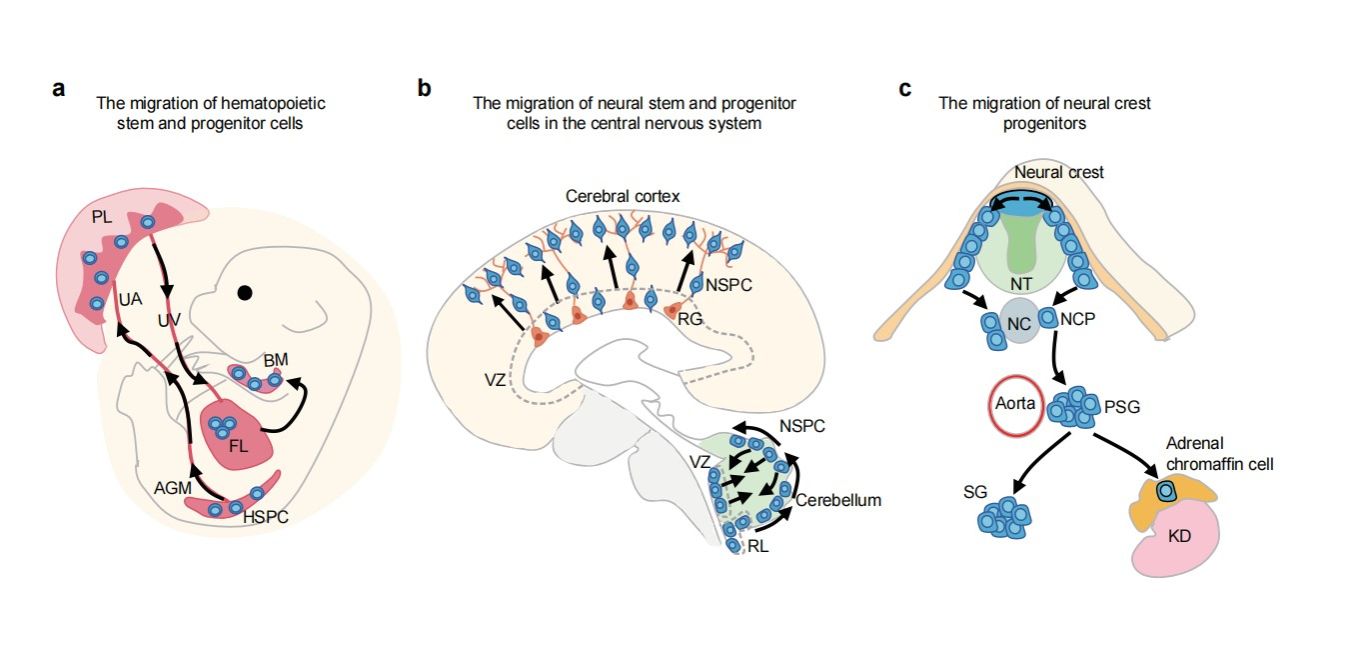
图1:造血和神经系统发育过程中干祖细胞的迁移
箭头代表造血干祖细胞(HSPC)和神经干祖细胞(NSPC)的迁移路径;AGM,背主动脉-性腺-中肾;PL,胎盘;FL,胎肝;BM,骨髓;UA,脐带动脉;UV,脐带静脉;RG,放射状胶质细胞,NT,神经管;NC,脊索;DA,背主动脉;PSG,初级交感神经节;SG,交感神经节;KD,肾脏。
基于上述比较分析,团队提出儿童肿瘤可能存在一条共同发育机制:发育中的组织干祖细胞在增殖与分化并行时,DNA复制与基因转录同时处于高负荷状态,二者可能发生冲突并诱发复制应激与基因组不稳定;当干祖细胞处于迁移、定植或“保护性微环境”尚未成熟的阶段,其基因组更容易在内源性刺激(如代谢中间产物)与外源性刺激(如药物等基因毒物)作用下受到损伤并形成突变。一旦关键突变在特定发育窗口期产生,可能被后续发育过程放大并固化,进而启动恶性疾病的发生与演进(图2)。
该观点的提出,为理解儿童肿瘤高发系统的共同特征及其早期起源提供了新的理论坐标,也为未来识别发育易感窗口、解析“干祖细胞—微环境”保护机制、以及探索风险评估与预检预防策略提供了新的研究方向(图2)。
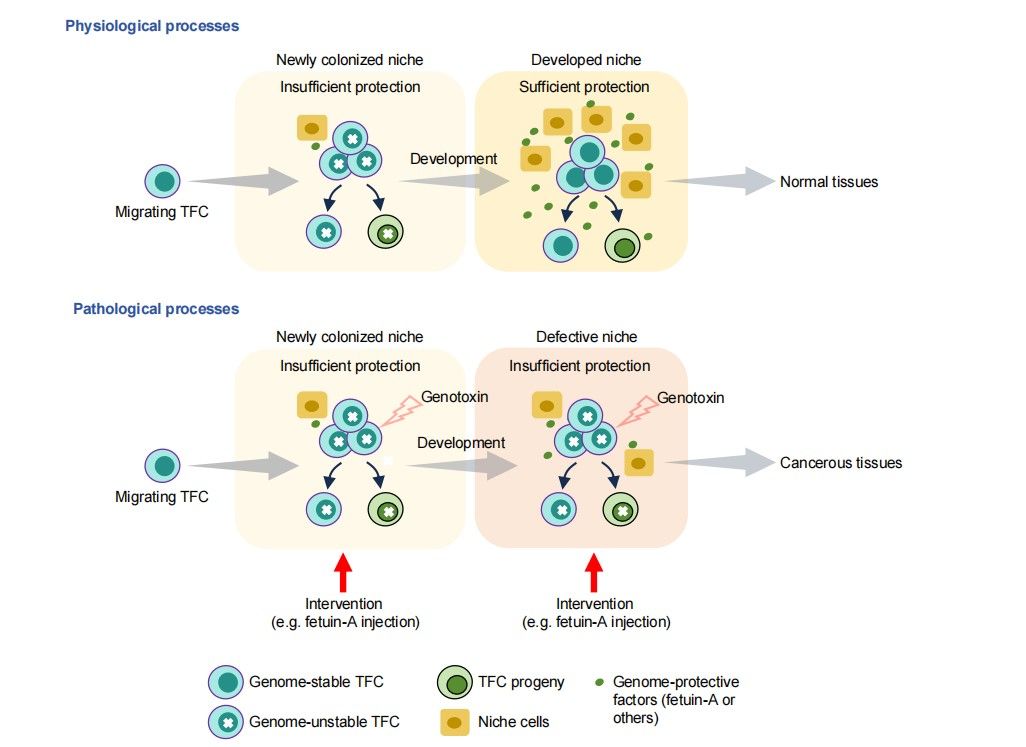
图2:儿童肿瘤的发病机制和预防策略
文章强调,围绕这一框架的进一步研究有望推动发育生物学、干细胞生物学、遗传与表观遗传学、肿瘤学以及妇产科与儿科学等多学科协同,形成从机制认识到转化应用的系统性推进,并吸引科研或投资基金注入。
作者与资助
上海交通大学医学院郭晓林研究员,上海儿童医学中心朱华博士为文章共同第一作者,上海交通大学医学院洪登礼教授为论文通讯作者;该研究获得了国家自然科学基金委、国家转化中心(基地)的资助。