溶酶体是细胞内负责降解和回收物质的关键细胞器,其膜的完整性对于维持细胞稳态至关重要。已有研究表明,多种外界刺激可导致溶酶体膜损伤并激活相应的修复应答(endolysosomal damage response,ELDR)。然而,在能量匮乏(如饥饿)等生理性应激条件下,溶酶体膜是否会发生损伤,以及细胞如何在此类条件下维持溶酶体完整性,仍缺乏系统认识。

近日,病理生理学系钟清、留筱厦课题组在Cell Research发表封面论文:Repair of damaged lysosome by TECPR1-mediated membrane tubulation during energy crisis。该研究首次发现,在能量危机条件下,溶酶体在摄取脂滴作为替代能量来源的过程中会发生膜损伤,并揭示了TECPR1蛋白通过识别损伤膜上富集的磷脂酰肌醇4-磷酸(PI4P),与驱动蛋白KIF1A协同驱动溶酶体膜管化,从而清除受损膜组分并完成膜修复的全新机制。该研究确立了TECPR1在溶酶体修复中的新功能,揭示了其在能量应激适应与肝脏保护中的关键作用,并为理解溶酶体修复机制及其在代谢性及溶酶体相关疾病中的作用提供了新的理论依据。

图1 封面图片。(封面介绍:“舍弃局部以保全整体”的古老生存智慧,在壁虎断尾中得到了生动体现,而这一策略在细胞层面同样存在于溶酶体的修复过程中。钟清等揭示了当溶酶体发生损伤时,会招募TECPR1协调修复性膜管的形成,通过一种具有策略性的“切除”机制来确保细胞器的存活。该机制在能量应激条件下对维持细胞结构完整性至关重要,展现了细胞在进化过程中形成的“以退为进”的生存法则。)(CCMU杨临宇 供图)
为探究能量应激对溶酶体稳态的影响,研究团队以富含脂滴的肝癌细胞HepG2为模型,通过葡萄糖饥饿或蛋氨酸–胆碱缺乏培养模拟细胞能量危机。研究者发现,在能量匮乏条件下,溶酶体显著增强对脂滴的摄取以满足能量需求,然而这一适应性过程却意外引发了溶酶体膜的破裂。通过功能筛选,研究团队鉴定出TECPR1是修复该类生理性损伤以及化学损伤剂LLOMe诱导的溶酶体膜通透性升高的关键因子。
为阐明TECPR1介导的溶酶体修复机制,研究者进一步开展了系统的机制研究。他们发现,在溶酶体膜受损后,TECPR1可通过其N端Dysferlin结构域特异性识别并结合损伤部位富集的PI4P,从而被招募至受损溶酶体膜表面。随后,通过免疫共沉淀结合蛋白质谱分析,研究者发现TECPR1与驱动蛋白KIF1A存在相互作用。共聚焦显微成像结果显示,TECPR1与KIF1A在受损溶酶体上显著共定位,并协同促进溶酶体膜表面管状结构的形成。研究团队将这一新型溶酶体膜修复方式命名为TTLMR(TECPR1-mediated tubulation for lysosome membrane repair)。
在体外生化重建实验中,研究者进一步验证了该修复机制的充分性。利用富含PI4P的巨型单层脂质体(GUVs)模拟受损溶酶体膜,结果表明,仅TECPR1与KIF1A的共同存在即可驱动膜管结构的形成,直接证明了TECPR1–KIF1A轴在溶酶体膜管化修复中的核心作用。
进一步的功能研究显示,TECPR1介导的修复通路对于细胞在能量危机下的存活至关重要。抑制TECPR1功能会导致溶酶体损伤持续加重、细胞内脂质代谢紊乱以及细胞死亡显著增加。更为重要的是,在高脂饮食诱导的MAFLD小鼠模型中,TECPR1基因缺失小鼠在经历饥饿刺激后表现出更严重的肝脏损伤、炎症反应和脂质堆积,凸显了TECPR1在机体整体代谢稳态维持中的不可替代作用。
综上,该研究首次报道了能量危机条件下溶酶体摄取脂滴引发膜损伤这一新的生物学现象,并系统阐明了由TECPR1–KIF1A轴驱动、通过膜管化(TTLMR)清除受损膜组分的溶酶体修复新机制。这一发现不仅拓展了人们对溶酶体质量控制与能量应激适应机制的认识,也为代谢性疾病和溶酶体相关疾病的干预提供了新的潜在靶点。
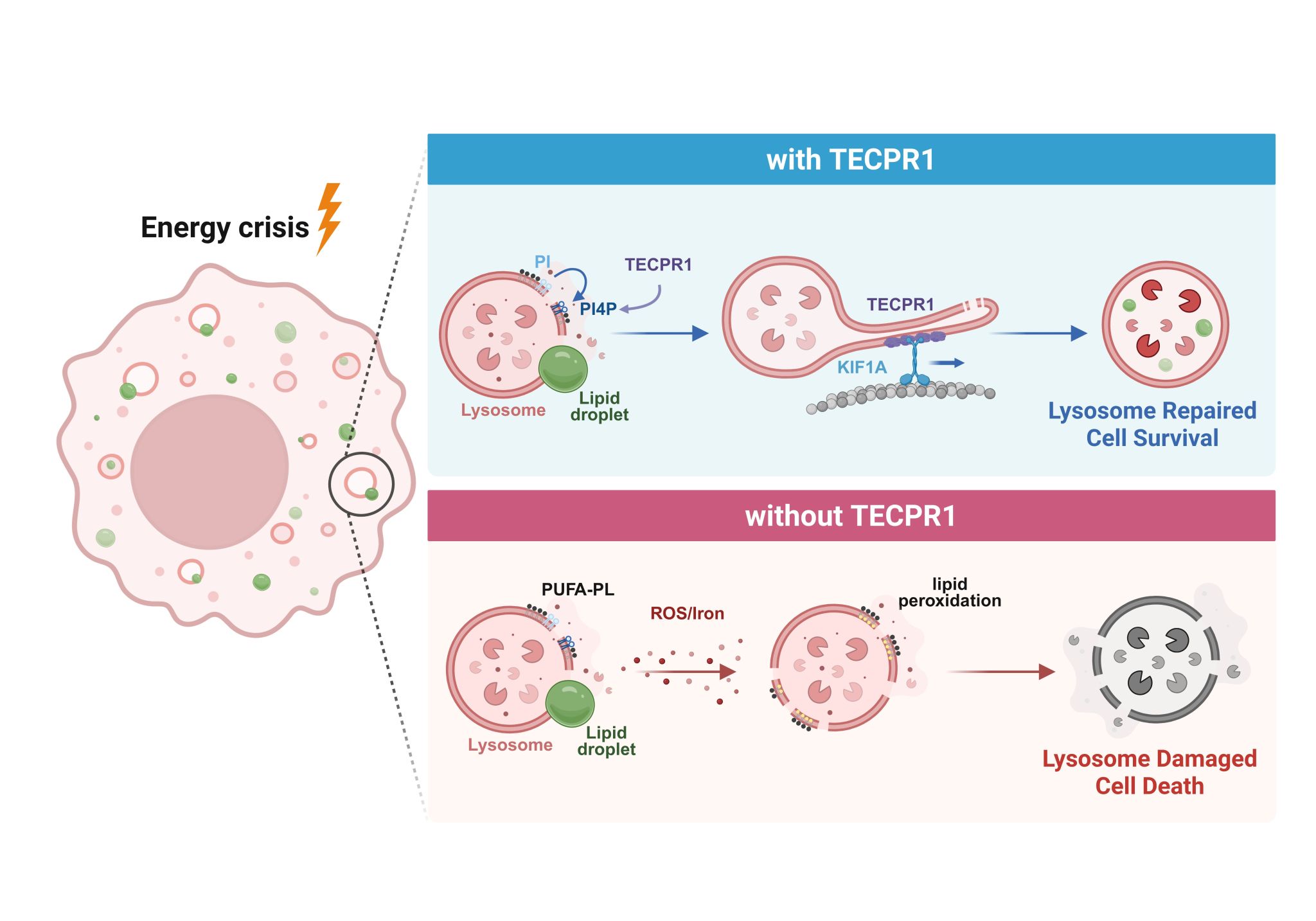
图2 TECPR1调控溶酶体损伤修复的模式图
钟清课题组博士后陈含脉博士、上海交通大学附属第九人民医院博士生张超俊为本文的共同第一作者,钟清教授和留筱厦副研究员为本文的共同通讯作者。