钠离子是细胞内含量最丰富的阳离子,在维持细胞膜电位、调节胞内渗透压以及保障细胞正常生理功能方面发挥着至关重要的作用。为维持钠离子稳态,细胞进化出了精密而高效的调控体系,包括各类离子通道以及高度依赖能量的钠钾泵。然而,在多种病理条件下,如缺血性损伤、高渗应激及器官衰竭等,细胞内钠离子可发生异常积聚,并与细胞死亡密切相关。但钠离子过载如何被感知、如何驱动细胞死亡,其分子机制长期未明。
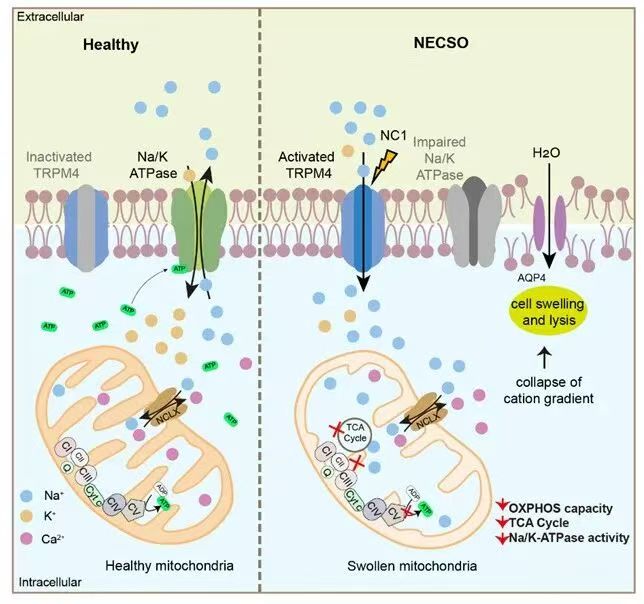
围绕这一关键问题,上海交通大学医学院钟清研究团队开展了系统而深入的研究。团队先于2023年报道,小分子化合物 Necrocide-1(NC1)可诱导一种不同于坏死性凋亡(necroptosis)、铁死亡(ferroptosis)、焦亡(pyroptosis)及其他已知通路的细胞坏死形式¹。通过全基因组 CRISPR-Cas9 筛选,研究人员进一步鉴定出非选择性单价阳离子通道 TRPM4(transient receptor potential cation channel subfamily M member 4)在 NC1 诱导的细胞坏死中起关键作用,并证实 NC1 通过直接结合并持续性激活 TRPM4,引发显著的 Na⁺ 内流,从而驱动细胞坏死的发生。基于这一核心特征,该死亡方式被定义为一种以钠离子过载为主要特征的新型细胞坏死形式——NECSO(necrosis by sodium overload)。研究还发现,NECSO 在表型上与能量衰竭诱导的坏死具有高度相似性²(专家点评Nat Chem Biol | 钟清/李扬课题组合作定义钠过载细胞死亡)。然而,NECSO 中的能量代谢特征、能量状态如何调控其发生,以及 TRPM4 介导的钠离子内流如何执行这一死亡程序,仍有待阐明。
近日,钟清团队与清华大学药学院胡泽平团队合作在Nature Communicatios在线发表了题为Sodium disrupts mitochondrial energy metabolism to execute NECSO的研究论文,揭示了 TRPM4 介导的 Na⁺ 内流通过破坏线粒体能量代谢,从而执行 NECSO 的分子机制。

研究人员在对NECSO中的关键事件(包括钠离子内流、ATP水平变化及其细胞膜损伤)进行时序性分析时发现,Na+内流在NECSO早期就发生,证明其并非细胞死亡过程中的被动伴随现象,而是直接触发 NECSO 的关键起始事件。尤为值得注意的是,ATP 水平的下降同样发生在 NECSO 的早期阶段,而细胞膜泄漏(如 PI 摄取和 LDH 释放)则明显滞后,且进程相对缓慢。这一特征提示:能量生成障碍可能是调控 NECSO 的核心环节,同时也暗示 NECSO 中的质膜破裂并非瞬时、剧烈的过程,而是以相对“温和”的方式逐步发生。功能性实验进一步支持了这一观点, 当研究人员通过补充creatine或α-Lipoic acid 来促进ATP生成时,NECSO可被显著抑制,证明ATP的下降不是NECSO发生时的伴随现象,而是促进NECSO发生的重要因素。
研究人员进一步通过Seahorse、活细胞成像、电镜等手段,证明在 NECSO中, ATP生成的显著下降主要源于线粒体功能障碍。在NECSO早期阶段,线粒体内即出现明显离子紊乱(表现为线粒体Na+的增加及Ca2+的下降),伴随着线粒体膜电位降低、耗氧率下降及线粒体的肿胀。此外,清华大学胡泽平团队的代谢组学分析显示,三羧酸循环(TCA cycle)相关代谢物在 NECSO 中全面累积,提示 TCA 循环受阻。这些结果均表明NECSO伴随着严重的线粒体能量代谢障碍。
通过使用等渗的NMDG⁺置换细胞外液中的Na⁺以阻断Na⁺内流,可显著减轻NECSO中的线粒体损伤;而敲除TRPM4则能完全逆转NECSO所引起的线粒体损伤和能量代谢障碍。这些结果进一步表明,NECSO中的线粒体功能障碍和能量代谢异常均位于TRPM4介导的Na+内流的下游。
NCLX是位于线粒体内膜上的关键钠钙交换蛋白3,它可被胞浆中增高的Na+激活。研究人员发现TRPM4介导的胞浆Na+过载通过激活NCLX,导致线粒体内Na+增加,并同时促进线粒体Ca2+流出。线粒体内累积的Na+通过抑制线粒体复合物II+III的活性,从而抑制氧化磷酸化;而线粒体Ca2+是TCA循环内多个脱氢酶的辅助因子4,其减少使TCA循环受到抑制,最终导致线粒体ATP生成能力下降。
钠钾泵是位于细胞膜上维持细胞Na+稳态的核心蛋白,其正常运作高度依赖 ATP 供应。匮乏的能量使得钠钾泵活性在NECSO中受到显著抑制,进而诱发细胞内发生“二次”钠离子过载,使得细胞内离子梯度进一步崩塌,导致细胞内渗透压增加、水分子大量涌入,最终导致细胞肿胀、裂解。使用渗透性保护剂或抑制水通道蛋白AQP4(包括药物抑制及 siRNA 干扰),均可以显著抑制NECSO中的膜破裂。
综上,本研究发现了能量生成是NECSO的重要调控因素,阐明了TRPM4介导的Na⁺内流通过激活NCLX通道影响线粒体离子稳态,进而抑制TCA循环和氧化磷酸化,导致能量匮乏,并进一步使钠钾泵失活、细胞离子梯度崩塌,最终导致细胞肿胀、裂解。
NECSO拓展了我们对细胞死亡形式的理解,Na⁺不仅是渗透压和膜电位的调节者,还可作为一种能量代谢的调控因子,深度参与程序性细胞死亡。对 NECSO 分子通路的解析,不仅为理解以 Na⁺ 升高为特征的病理状态提供了新的理论框架,也为缺血性损伤、感染及器官衰竭等相关疾病的干预策略提供了潜在的新靶点。
上海交通大学医学院博士生乔钰惠(现就职于上海交通大学医学院附属上海儿童医学中心)为本论文的第一作者,上海交通大学医学院钟清研究员、清华大学药学院胡泽平研究员和上海交通大学医学院付婉助理研究员为共同通讯作者。
原文链接:
https://www.nature.com/articles/s41467-025-67181-x