2025年10月23日,上海交通大学医学院许悦课题组在Cell Host & Microbe杂志上发表了题为”Bacterial effector OspB hijacks apoptosis through peptide-bond recombination of BH3 domain proteins”的研究论文。本文首次发现志贺氏菌效应蛋白OspB可通过一种新颖的肽键重组活性,将促凋亡BH3-only蛋白与BAX/BAK在核心BH3结构域发生交换,实现对宿主细胞凋亡的抑制作用。

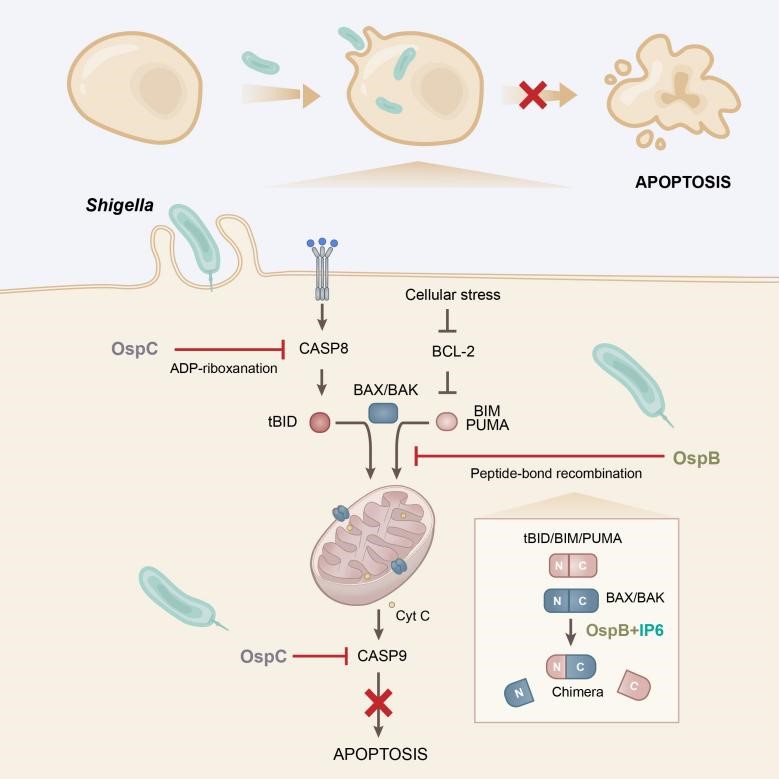
志贺氏菌是一种具有高度传染性的革兰氏阴性菌,引发细菌性痢疾,每年导致约60万人死亡。作为一个胞内生存细菌,志贺氏菌通过III型分泌系统主动分泌效应蛋白抑制真核细胞的程序性死亡通路,以获得在宿主细胞中的增殖。例如,志贺氏菌效应蛋白OspC3通过ADP-riboxanation修饰caspase-4/11抑制细胞焦亡,OspD3通过蛋白酶活性切割RIPK1/3阻断程序性坏死。然而,志贺氏菌抑制凋亡的具体机制仍有待解析。
首先,研究人员采用经典的TNF-α联合CHX诱导细胞凋亡模型,筛选具有细胞凋亡抑制活性的效应蛋白。经过表达筛选,鉴定出志贺氏菌OspB和OspC家族蛋白均可显著抑制细胞凋亡发生。利用细菌感染实验验证,细菌分泌的OspB与OspC1可独立高效阻断凋亡通路。OspC1与其家族成员OspC3具有相似的酶学活性,可通过ADP-riboxanation修饰多个凋亡性caspases,而抑制凋亡。
研究人员继续探索OspB抑制细胞凋亡的作用靶点。实验结果表明OspB可以抑制TNF-α联合CHX、DNA损伤药物Etoposide、BCL-2抑制剂与tBID诱导表达引起的凋亡,但不能抑制诱导caspase-9自激活引起的凋亡,提示OspB作用于BCL-2家族蛋白或其下游,且在caspase-9上游。进一步,研究发现OspB可以抑制凋亡发生时BAX/BAK的寡聚与线粒体细胞色素c的释放。并通过质谱分析OspB在凋亡条件下的宿主互作蛋白,发现BAX/BAK与OspB明显结合,提示OspB的可能作用靶点是BAX/BAK蛋白。
结构预测分析显示,OspB是一个结合IP6的半胱氨酸蛋白酶样蛋白。但体外实验表明,OspB并不能直接切割BAX蛋白,通过质谱也没有检测到BAX蛋白发生分子量改变。于是,研究人员继续探索tBID诱导条件下BAX不能寡聚激活的原因。实验发现,当OspB存在下共表达tBID与BAX时,观察到tBID抗体识别出现一条明显发生电泳迁移的条带。经过一系列截断突变与质谱分析发现,该条带是由tBID的N端片段与BAX的C端片段通过肽键重组形成的嵌合/融合蛋白。这一反应涉及两个蛋白内部肽键的断裂与重新连接,发生在BH3结构域保守天冬氨酸残基处。所形成的tBID-BAX嵌合蛋白失去了线粒体外膜打孔的能力,因此无法介导细胞凋亡的发生。
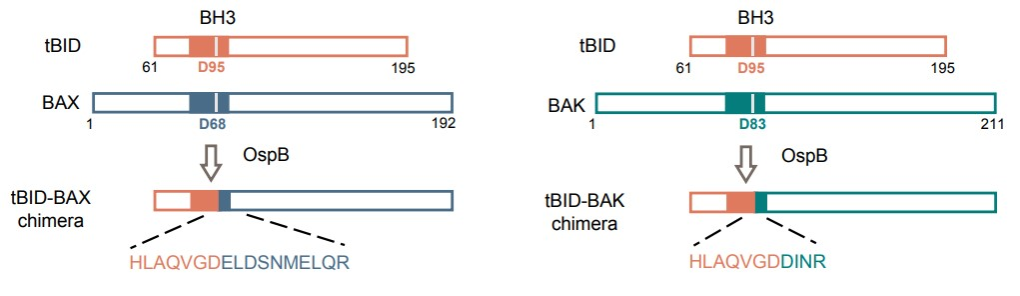
进一步研究发现,OspB的催化活性具有严格的底物特异性。除tBID外,OspB还可催化同一类直接激活BAX/BAK的BH3-only蛋白(PUMA和BIM)与BAX发生类似的肽键重组反应,形成相应的嵌合蛋白。突变分析实验证实,OspB对BH3结构域的识别依赖于BH3结构域的完整以及其中重要的疏水残基。
OspB对于志贺氏菌的体内感染也发挥重要作用。动物感染模型显示,与野生型志贺氏菌相比,同时缺失ospB及ospC1/C2的志贺氏菌突变体在小鼠肝脏脾脏及肠系膜淋巴结中的定植能力显著下降。回补表达野生型OspB(而非酶活突变体)可恢复其毒力,证明OspB通过酶学活性抑制宿主细胞凋亡,从而促进志贺氏菌在宿主体内存活与扩散。
研究继续通过序列比对发现多种细菌中存在OspB的同源蛋白。尽管这些同源蛋白存在保守的催化位点,但其活性和底物识别特异性存在差异。例如,霍氏格里蒙特氏菌(Grimontia hollisae)中的同源蛋白OspBG.h.具有与志贺氏菌OspB相似的肽键重组酶活性,而来自邦戈沙门氏菌(Salmonella bongori)的OspBS.b.则更倾向于直接水解tBID,而非催化其与BAX发生肽键重组。进一步结构域交换实验鉴定出志贺氏菌OspB中一段关键区域(第91-120位氨基酸)负责特异性识别tBID/BAX蛋白复合物。该区域的存在是决定其倾向于催化肽键重组这一独特的酶学活性的关键结构基础。
综上所述,本研究首次揭示了一种全新的细菌抑制宿主细胞凋亡机制,志贺氏菌效应蛋白OspB通过肽键重组活性,特异性催化促凋亡BH3-only蛋白(tBID、BIM或PUMA)与BAX/BAK在其保守的BH3结构域之间发生特异性交换,生成嵌合蛋白,从而不可逆地阻断凋亡通路。这一机制在催化特性上区别于传统的翻译后修饰或转肽过程,代表了一类全新的细菌效应蛋白催化机制,未来有望通过改造并应用于蛋白质编辑领域。此外,靶向BCL-2家族的药物(如Venetoclax)已在临床治疗中取得重要突破,OspB以其独特的BH3结构域靶向与重组能力,也为开发细胞死亡调控工具提供了新的思路。
上海交通大学医学院许悦研究员为本论文的通讯作者,博士生邵跃、实验师杨丹丹为共同第一作者。博士生高新光、王明慧、牛田野和医学院质谱平台夏立博士、孟丽媛老师为研究做出重要贡献。北京生命科学研究所邵峰院士和生物物理研究所丁璟珒研究员给本研究提供了宝贵意见。本研究得到了科技部、国家自然基金、上海市科委、香港特别行政区研究资助局以及上海市细胞稳态调控与疾病前沿科学研究基地的资助和支持。