2025年6月19日,上海交通大学医学院王戈林团队在Molecular Cell杂志上发表了题为“The NAMPT enzyme employs a switch that directly senses AMP/ATP and regulates cellular responses to energy stress”的研究论文。该研究首次揭示NAD⁺合成关键酶烟酰胺磷酸核糖转移酶(NAMPT)可直接感应AMP/ATP变化,兼具“能量传感器”与“NAD⁺合成控制开关”的双重功能,协调ATP和NAD⁺两条基本能量代谢通路,为缺血性脑卒中等疾病的治疗提供了潜在药物靶点。
烟酰胺腺嘌呤二核苷酸(NAD⁺)是动植物体内广泛分布的重要代谢物,既作为氧化还原反应的辅酶参与能量代谢和其他代谢过程,也作为底物参与一系列NAD⁺消耗酶介导的信号转导,调控DNA修复、基因表达调控、干细胞稳态、神经退行及炎症反应等生命过程。随着机体衰老,NAD⁺水平显著下降,并与多种衰老相关疾病,如神经退行性疾病、心血管疾病、代谢综合征、感染性和炎症性疾病等的发生发展密切相关【1-2】。
在哺乳动物细胞中,从烟酰胺(NAM)起始的补救合成途径是NAD⁺的主要来源,NAMPT是该通路的限速酶,对维持细胞内NAD⁺稳态至关重要。已有研究显示,NAMPT基因缺失可致小鼠胚胎致死,而提高其表达或药物干预提升其活性则具有广泛的治疗潜力【3-5】。在生理状态下,NAMPT依赖ATP自磷酸化维持活性;然而在能量应激条件下,其调控机制仍是未解之谜。虽然多种应激刺激可诱导NAMPT表达上调,但这种上调却不足以补偿NAD⁺的耗竭,提示可能存在更为精细的调控机制。
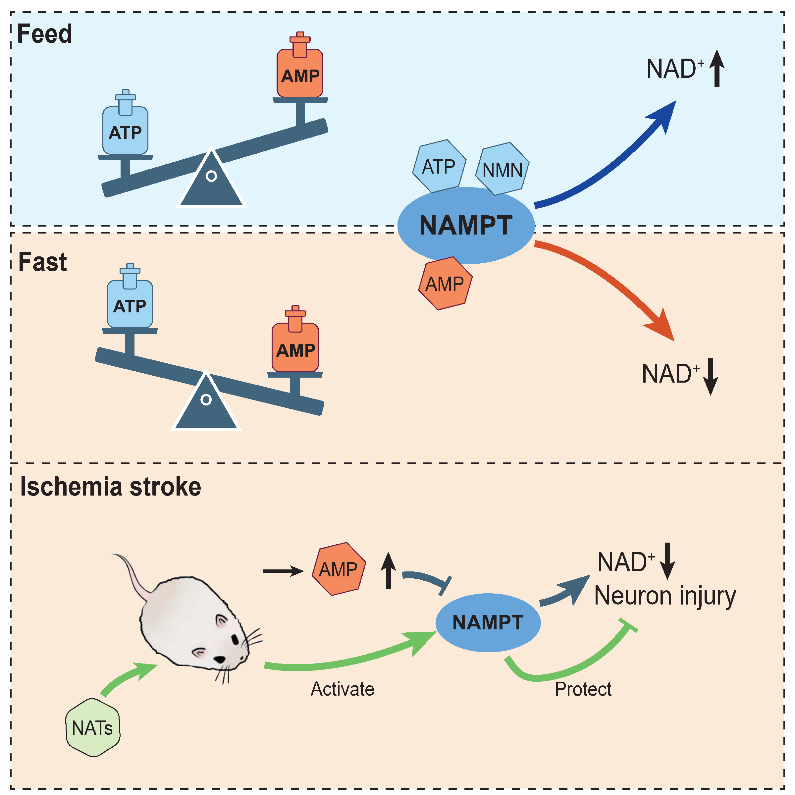
该研究通过禁食诱导小鼠进入能量应激状态后,系统绘制了肝脏代谢物-蛋白质互作网络,发现AMP在能量匮乏时特异性结合NAMPT。结构分析显示,AMP与NAMPT活性位点的结合方式与其产物NMN高度相似。通过一系列酶学实验,研究团队发现AMP能够剂量依赖性地抑制NAMPT催化活性,并阻断ATP介导的NAMPT自磷酸化。此前,研究团队已通过高通量药物筛选和基于靶点结构的理性药物设计,开发出靶向NAMPT的小分子激活剂(NATs),在化疗诱导的外周神经病变动物模型中表现出良好的神经保护效果【5】。本研究进一步发现,NATs能够竞争性减轻AMP对NAMPT的抑制作用。
体内实验结合代谢组学分析发现,短期禁食可上调NAMPT并提升NAD⁺水平,而长期禁食则因AMP持续升高反而导致NAD⁺下降,提示NAMPT虽表达上调,但功能受AMP抑制。AMP积累不仅源于ATP降解,还与嘌呤合成增强有关。无论是施加AMP类似物AICAR,还是激活NAD⁺水解酶SARM1,均可导致AMP升高、NAMPT抑制及NAD⁺耗竭;而NAMPT激活剂NAT-5r则可部分逆转该过程。
在脑卒中、心肌梗死等缺血性疾病中,细胞因缺氧缺糖导致ATP耗竭、AMP上升,进而引发NAD⁺耗竭和细胞死亡。传统方法难以有效干预这种能量代谢危机。研究进一步在原代神经元糖氧剥夺模型和小鼠缺血性脑卒中模型中证实,NAMPT激活剂可恢复NAD⁺水平、提高神经元存活率并减轻组织损伤,展现了良好的临床转化潜力。此工作不仅阐明了NAMPT通过直接感应AMP/ATP变化调控能量应激的新机制,也为能量匮乏相关疾病的临床药物开发提供了新策略。
上海交通大学医学院王戈林研究员为本论文的通讯作者。课题组成员俎玉萌、吴愁、姚红、夏禹玥和张若曦为该论文的共同第一作者。该研究得到了美国德克萨斯大学西南医学中心Steven McKnight教授、肯塔基大学Young-Sam Lee教授、清华大学唐叶峰教授等的帮助,并获得国家自然科学基金、清华-北大生命科学联合中心、清华大学高精尖结构生物学中心、山西医科大学-清华大学医学院前沿医学协同创新中心、丰田、Boehringer Ingelheim等的资助。
原文链接:https://doi.org/10.1016/j.molcel.2025.05.022
参考文献
1. Garten, A., Schuster, S., Penke, M., Gorski, T., de Giorgis, T., and Kiess, W. (2015). Physiological and pathophysiological roles of NAMPT and NAD metabolism. Nat Rev Endocrinol 11, 535-546. 10.1038/nrendo.2015.117.
2. Covarrubias, A.J., Perrone, R., Grozio, A., and Verdin, E. (2021). NAD(+) metabolism and its roles in cellular processes during ageing. Nat Rev Mol Cell Biol 22, 119-141. 10.1038/s41580-020-00313-x.
3. van der Veer, E., Ho, C., O'Neil, C., Barbosa, N., Scott, R., Cregan, S.P., and Pickering, J.G. (2007). Extension of human cell lifespan by nicotinamide phosphoribosyltransferase. J Biol Chem 282, 10841-10845. 10.1074/jbc.C700018200.
4. Wang, G., Han, T., Nijhawan, D., Theodoropoulos, P., Naidoo, J., Yadavalli, S., Mirzaei, H., Pieper, A.A., Ready, J.M., and McKnight, S.L. (2014). P7C3 neuroprotective chemicals function by activating the rate-limiting enzyme in NAD salvage. Cell 158, 1324-1334. 10.1016/j.cell.2014.07.040.
5. Yao, H., Liu, M., Wang, L., Zu, Y., Wu, C., Li, C., Zhang, R., Lu, H., Li, F., Xi, S., et al. (2022). Discovery of small-molecule activators of nicotinamide phosphoribosyltransferase (NAMPT) and their preclinical neuroprotective activity. Cell Res 32, 570-584. 10.1038/s41422-022-00651-9