生物化学与分子细胞生物学系的贾浩副研究员等最近在Molecular Therapy杂志上发表了“LncRNA IFITM4P is activated through LPS/TLR4 and promotes immune escape by up-regulating PD-L1 via dual mechanism during oral carcinogenesis”学术文章。
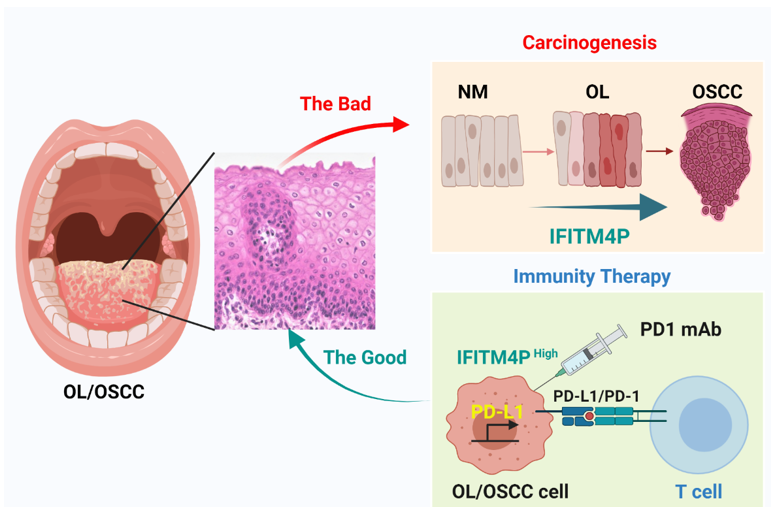
口腔白斑病(oral leukoplakia)是最重要的口腔黏膜潜在恶性病变之一,上皮异常增生是其病理学特征。世界卫生组织将口腔黏膜癌前病变和癌前状态归为口腔黏膜潜在恶性病变,口腔白斑病从无异常增生、轻-中-重度异常增生到恶变的各阶段较明确,而且口腔部位相对表浅易于观测,可作为全身癌前病变的代表疾病,是癌前病变发生发展的良好研究模型。目前,手术、激光、既有药物等局部治疗和全身用药均不能有效治疗口腔癌前病变的复发、病损多发、区域化多次癌变。针对口腔白斑病的化学预防药物临床研究试验亦证实维A类和EGFR靶向药物治疗均无效。因此,针对白斑病研发具有抑制和逆转作用的全身用药,特别是对于口腔黏膜具有区域化癌变潜能的患者,具有重要的临床意义和社会价值。
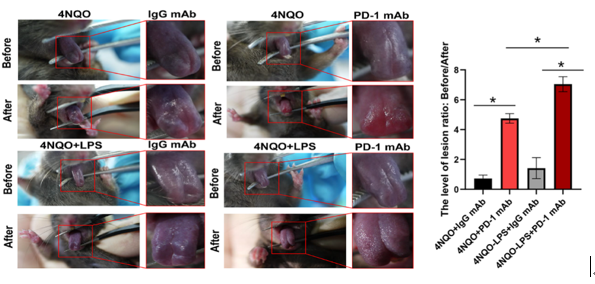
研究人员利用口腔粘膜白斑组织和口腔鳞癌病人组织样本通过高通量筛选的方法,分析发现了PD-L1的表达水平随着恶变程度的增加而升高。患有炎症的口腔粘膜白斑病人的恶性进展更快。在实验中首次构建了LPS(脂多糖)联合4NQO诱导的【炎症-粘膜白斑小鼠模型】进行治疗研究,通过给疾病小鼠注射PD-1抗体后,利用临床指标诊断发现PD-1抗体可以显著阻断白斑恶性进展,令人惊喜的是炎症诱发的小鼠白斑恶性进展模型对于PD-1抗体的效果更好。
进一步团队研究人员利用基因高通量筛选发现:相较于正常组织,在人的口腔粘膜白斑/鳞癌组织中长链非编码RNA IFITM4P高表达,其表达水平随着恶变程度的增加而升高。研究还发现了非编码RNA受到LPS刺激下可以进行核质穿梭,具体的原因还不清楚。在细胞质内,IFITM4P与SASH1形成复合体,通过磷酸化激活了TAK1-NF-κB途径,NF-κB的入核促进了PD-L1的表达。LPS的处理可以促进IFITM4P的入核,进一步通过招募去甲基化酶KDM5A结合并抑制了PTEN的表达,进而削弱了PTEN对PD-L1的抑制作用,升高了PD-L1的表达。IFITM4P通过胞质和胞核两种机制协同促进了白斑/鳞癌细胞中PD-L1的表达,促使口腔粘膜白斑的免疫逃逸。因此,IFITM4P可作为早期诊断口腔粘膜白斑恶变的指标。同时我们利用动物模型也发现了IFITM4P高表达的荷瘤小鼠对PD-1单抗的响应更好,可考虑将PD-1单抗作为治疗高表达IFITM4P口腔粘膜白斑的有效治疗方式。
上海交通大学医学院第九人民医院口腔粘膜科副主任医生施琳俊,上海交通大学基础医学院生化细胞系硕士生杨于权,博士生李梦莹为该论文的共同第一作者;上海交通大学基础医学院的贾浩副研究员,侯照远研究员及上海交通大学医学院第九人民医院口腔粘膜科沈学敏主任为该论文的共同通讯作者。该工作还得到了国家自然科学基金、上海市科技启明星等经费的资助。
原文链接:
LncRNA IFITM4P is activated through LPS/TLR4 and promotes immune escape by up-regulating PD-L1 via dual mechanism during oral carcinogenesis - ScienceDirect