2020年6月24日,上海市免疫学研究所邓刘福研究员团队在国际转化医学领域著名期刊Science Translational Medicine杂志在线发表题为“cGAS-STING–mediated DNA sensing maintains CD8+ T cell stemness and promotes antitumor T cell therapy”的研究论文(第一作者为助理研究员李文文和博士后路璐)。该研究揭示了内源性cGAS-STING信号通过维持CD8+ T细胞的“干性”促进T细胞抗肿瘤免疫应答的作用机制,为提高临床T细胞治疗效果提供了新的策略和依据。

免疫治疗是当前肿瘤治疗领域的热点,基于T细胞的免疫治疗在根除实体瘤方面遇到了多重挑战。T细胞治疗最大的优势在于可特异性识别肿瘤抗原,从而有效杀伤肿瘤细胞防止肿瘤免疫逃逸。但持续的抗原刺激会导致T细胞耗竭,表面抑制性受体(如PD-1等)增加及效应功能下降。目前,可以通过阻断PD-1通路重新激活耗竭CD8+ T细胞应答,让“精疲力竭”的T细胞“满血复活”,但该策略仍受到T细胞质量的限制。因此如何改善T细胞的质量使免疫治疗的T细胞维持更长的时间,促使它们复制和扩增是提高T细胞治疗效果的新策略。
此前,研究人员发现耗竭性T细胞具有干细胞样细胞(Stem-cell like)和终末分化细胞(Terminal)两个主要亚群。干细胞样T细胞以自我更新、扩增和多能性为特征,对于T细胞治疗和免疫检查点阻断治疗实现持久的抗肿瘤反应至关重要。所以研究人员正在探索如何调节干细胞样T细胞的产生和维持其“干细胞特性(stemness)”以达到优化T细胞治疗和免疫检查点阻断治疗的目的。然而,内源性非转录调节因子对T细胞“干性”的调节作用知之甚少。
cGAS(cyclic GMP–AMP synthase)-STING通路是启动抗肿瘤天然免疫应答的重要途径,有望成为使肿瘤由“冷”转“热”的新一代免疫治疗靶点。该通路的作用机制为:cGAS感受DNA,产生第二信使cGAMP,进而活化STING接头蛋白形成二聚体,通过招募TBK1激活IRF3形成蛋白复合物来诱导IFN-β的产生。在肿瘤微环境中cGAS-STING通路已成为主导免疫检查点阻断、“do not eat me”信号阻断、放疗或PARP抑制剂治疗等对细胞质DNA作出反应的主要途径。目前cGAS-STING通路的研究主要集中于肿瘤细胞以及天然免疫细胞上,发现其在肿瘤免疫、细胞衰老、炎症疾病以及病毒感染等过程中都发挥着非常重要的作用,但是对T细胞内的cGAS-STING通路的变化了解甚少,尤其在肿瘤微环境中。
该研究发现在癌症病人的外周血CD8+ T细胞中cGAS和STING表达显著下调,提示cGAS和STING对于CD8+ T细胞有着重要意义。应用T细胞回输治疗小鼠肿瘤模型证明,CD8+ T细胞内cGAS和STING缺失会削弱T细胞治疗肿瘤的效果。研究人员进一步利用遗传学、药理学工具以及阻断抗体来干扰cGAS-STING和I型干扰素信号,证明该途径对于维持抗肿瘤干细胞样CD8+ T细胞和最佳的抗肿瘤反应是至关重要的。且发现cGAS和STING通过调节TCF1和Slamf6的表达影响肿瘤微环境中耗竭性CD8+T细胞的“干性”。cGAS-STING介导的I型干扰素信号以自分泌的形式增强干细胞样CD8+ T细胞的分化,同时通过抑制Akt的活性来阻止效应因子的产生。此外,在体内或体外的刺激下,基因组DNA在CD8+ T细胞的胞浆中选择性地富集,是T细胞中cGAS-STING通路活化的关键。人的外周血中也存在这样一群细胞,既具有记忆细胞的特性,同时又具有干细胞的特征,命名为stem cell-like memory T cells(Tscm),这群细胞的增殖能力和抗肿瘤活性在所有T细胞亚群中是最强的。该研究发现STING激动剂diABZI-C3可促进健康志愿者和癌症病人外周血中的Naïve T细胞分化为Tscm亚群。更加令人振奋的是,进一步应用人源化小鼠模型发现STING激动剂可以显著提高CAR-T细胞治疗A549实体瘤的效率。
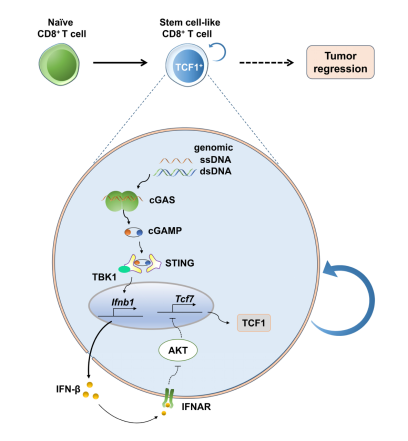
图1. cGAS-STING通路调节CD8+ T细胞干性的示意图
该研究从免疫治疗面临的临床问题出发,深入研究了CD8+ T细胞内源的cGAS-STING信号通路对T细胞的作用及机制;揭示了cGAS-STING通路通过维持CD8+ T细胞的“干性”提高T细胞的治疗效果;并在此基础上,证明激活STING通路可以显著提高人源CAR-T细胞治疗实体瘤的效率。该研究揭示了内源性cGAS-STING信号通过维持CD8+ T细胞的“干性”促进T细胞抗肿瘤免疫应答的作用机制,为临床治疗过程中合理设计新型T细胞疗法提供新的靶点(图1)。

最后,借用《西游记》中的孙悟空,来形象描绘该研究发现。西行取经途中,为了降魔除妖(肿瘤细胞),孙悟空(CD8+ T细胞)需要紧箍咒的法力(STING)和火眼金睛的魔力(cGAS),除却杂念,克服万千艰难险阻,获得真经,修成正果。
该研究受到国家自然科学基金、国家海外青年高层次人才计划、上海市科委和卫健委的资助,该研究还得到上海市免疫学研究所公共平台、上海交通大学基础医学院和仁济医院基础-临床创新研究中心研究平台、上海市妇科肿瘤重点实验室的支持。论文的第一作者是助理研究员李文文与博士后路璐,通讯作者为上海交通大学医学院上海市免疫学研究所邓刘福研究员、上海交通大学附属仁济医院狄文教授以及上海交通大学杨选明研究员。同时,该研究还获得了上海交通大学医学院程金科教授和苏冰教授、UT Southwestern Medical Center傅阳心教授、同济大学戈宝学教授和中科院生物物理研究所王盛典研究员的支持帮助。
文章链接:https://stm.sciencemag.org/content/12/549/eaay9013