近日,国际知名杂志ACS Catalysis (IF=12.221)在线发表了基础医学院张健等针对Ras蛋白的题为Deactivation Pathway of Ras GTPase Underlies Conformational Substates as Targets for Drug Design的研究论文,他们通过揭示Ras蛋白生物催化水解底物失活的动态过程,阐明了Ras动态过程中的中间失活构象,基于此发现了一个全新的隐式变构位点(Hidden Allosteric Site),为后续靶向Ras蛋白的药物设计开辟了新的途径。
Ras是著名的癌基因,它的突变会在超过30%的癌症中发生,而突变引起的Ras蛋白的异常激活也和癌症发病过程紧密相关。一直以来,人们对于Ras蛋白从激活到失活的转变的动态过程了解尚浅,对于Ras蛋白的结构研究也一直乏善可陈,虽然前期已经有多类靶向Ras蛋白的抑制剂被开发,但是它们无一能够最终被应用到临床上针对Ras蛋白介导的癌症的治疗当中,因此,Ras蛋白也一直被认为是不可成药的(undruggable)。
为了进一步探索在Ras蛋白上进行药物开发的可能性,研究者决定从它水解失活这一动态过程入手。利用基于Nudged Elastic Band方法的大规模分子动力学模拟以及马尔可夫链分析,他们发现了在Ras水解的通路上存在多个亚状态(substates)(图一)。
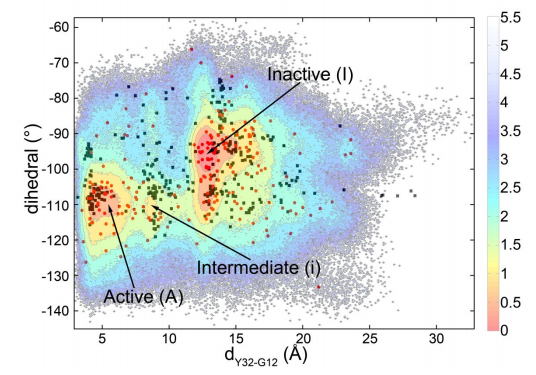
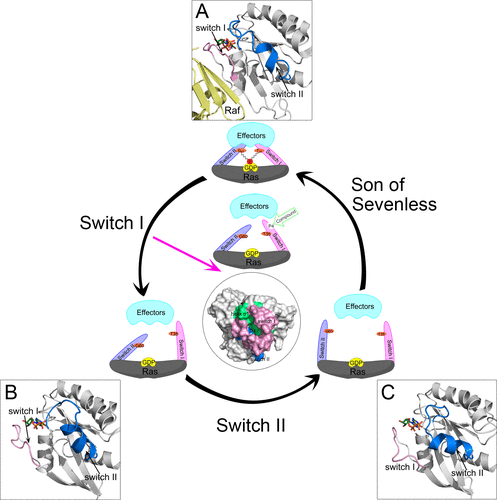
基于这些亚状态以及结构分析,研究人员提出了,Ras蛋白的失活过程将会是一个分步过程,即,水解的过程中,首先Ras蛋白中的SW1结构域发生摆动,与底物GTP之间的相互作用被破坏;随后进一步SW2结构域再发生摆动,与底物GTP之间的相互作用受影响。经历了上述两个分步的过程后,最终原本结合的GTP会被水解成为GDP,完成蛋白的水解失活过程(图二)。
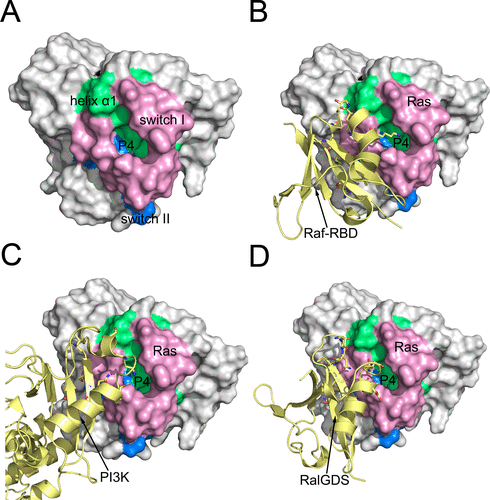
随后,基于上述所发现的一系列亚状态的结构,他们对其进行了隐藏在蛋白内部的变构药物位点(隐式变构位点)识别,并发现了一个全新的隐式变构位点P4(T20, I21,Q25, E31, I36, D38, I55)。该位点不仅会对于Ras蛋白自身的GTP酶酶活具有调节作用,并且还位于Ras蛋白和一系列效应蛋白(effector)相互作用的界面上(图三)。而利用突变实验,他们进一步阐明了这个位点的变构调节效应,证实了该位点对于Ras蛋白特异性的变构调节作用。该位点的发现将为后续针对Ras蛋白的变构药物开发提供指导,并且也为针对Ras与下游效应蛋白的蛋白相互作用调节剂的药物设计提供理论依据。
该研究以Ras蛋白为例,系统提出了在蛋白结构表面无变构位点情况下,如何发现“隐式变构位点”的方案,不仅为Ras提供了未来药物研发的新位点,也为更多此前被认为难成药靶标的变构药物设计提供了全新思路和经典案例。本工作第一作者为上海交通大学医学院陆绍永副教授、倪端(本科生)和王承祥(博士生),课题受到国家自然基金重大研究计划、科技部重大项目及重大新药创制等多个项目的资助。
原文链接:https://pubs.acs.org/doi/10.1021/acscatal.9b02556