近日,钟清团队与曹木青团队合作,在Nature Communications上发表研究论文:An Actin Filament Branching Surveillance System Regulates Cell Cycle Progression, Cytokinesis and Primary Ciliogenesis。研究发现中心体作为重要的信号传导中心通过监测中心体周围的微丝骨架网络调控细胞周期。微丝骨架茂盛则细胞分裂,反之稀疏的微丝骨架阻滞细胞周期。研究揭示了中心体蛋白OFD1 (Oral-Facial-Digital syndrome 1, OFD1) ,作为微丝II型成核促进因子(Nucleation Promoting Factors, NPFs),协同Arp2/3复合物调控中心体周围的微丝分支动态变化;同时发现,微丝分支动态性的改变导致OFD1通过“液-凝胶”相转变的形式失活并降解。去除OFD1或破坏OFD1-Arp2/3复合体的相互作用,激活RB通路促使增殖的非转化细胞退出细胞分裂周期进入静息状态(G0期),同时诱导细胞组装纤毛;在原癌基因诱导的转化细胞和大部分肿瘤细胞中去除OFD1,细胞虽可跨越上述细胞周期阻滞,但最终无法有效形成胞质分裂环,而发生不可逆的细胞死亡。研究揭示了中心体微丝骨架的细胞功能和调控机制,为肿瘤的治疗提供了新的思路和潜在靶点。
中心体是动物细胞主要的微管组织中心,调控细胞分裂和纤毛发生等关键细胞过程。近期研究发现,中心体周围存在高度动态的微丝骨架(Actin filaments)网络,而且中心体外围组分参与中心体周围微丝骨架网络的组装。作为细胞重要的骨架成分,微丝形成高度动态的分支骨架网络,通过快速组装与解聚,响应局部的生理或病理信号,调控细胞多项生命活动1-4。然而,中心体微丝的动态性如何被调控,以及中心体微丝网络动态调控所参与的细胞生理过程还不清楚。
钟清团队长期聚焦自噬的生化调控与功能研究,探索自噬与肿瘤等人类重大疾病的关系,开发疾病治疗的技术方法。曹木青团队多年来致力于纤毛的结构与功能研究,探索纤毛病的发病机制。团队的合作实现了优势互补,本研究通过使用体外生化重建与细胞超分辨荧光成像等技术发现:一方面,纤毛病相关蛋白OFD1可作为II型成核促进因子,其C末端存在一个保守的酸性A结构域(Acidic domain),用于结合激活Arp2/3复合物(actin-related protein 2/3 complex),并协同I型NFPs促进中心体微丝骨架网络的分支动态调控;另一方面,OFD1能够感知中心体微丝骨架网络的扰动,当骨架网络分支受到干扰,定位于中心体微卫星处的OFD1会从“液—液”相分离状态转变为“液—凝胶”状态失活或降解。
细胞周期调控失常和原纤毛缺失是多种肿瘤的特征5, 6,二者的调控是否相关,何种驱动机制调控了上述现象,尚不清晰。敲降OFD1或干扰OFD1与Arp2/3复合体的结合,正常细胞RPE1进入可逆的G0细胞周期阻滞,并伴随着纤毛的形成;恢复OFD1表达后,纤毛去组装,细胞重新进入分裂周期开始增殖。出乎意料的是,OFD1 敲降造成的细胞周期阻滞,并不依赖于原纤毛的形成或中心体缺陷激活的USP28-53BP1-p53-p21信号轴起作用。RNASeq分析发现,上述周期阻滞伴随着RB通路的激活。SV40 T Antigen编码基因是来源于病毒的原癌基因,SV40 T Antigen可以同时破坏p53-p21通路和RB-E2F通路,导致正常细胞发生恶性转化,具备肿瘤细胞的特性。在RPE1-SV40 TAg转化的细胞中,敲降OFD1,可诱导纤毛组装,细胞却不再发生G0细胞周期阻滞。值得注意的是,敲降OFD1后,细胞虽然跨越了G0细胞周期的阻滞,细胞数目却无法增长。追溯其原因,发现敲降OFD1后大部分细胞出现了明显多倍体现象,说明DNA可以完成复制,但胞质分裂出现紊乱。活细胞成像技术的应用进一步发现,OFD1除了定位于中心体与中心体微卫星周围,也分布在胞质分裂环附近,OFD1丢失导致胞质分裂环附近的微丝骨架变得疏松,表现出胞质分裂的缺陷和细胞分裂死亡。同样的,大部分的肿瘤细胞也表现出类似特点,敲降OFD1或干扰OFD1与Arp2/3复合物的结合,造成肿瘤细胞发生胞质分裂缺陷和细胞死亡。
通过对TCGA 数据库的分析发现,与对应的正常组织相比,结直肠癌、胶质母细胞瘤、肾癌、肝癌、肺癌和前列腺癌等多种肿瘤组织中OFD1的表达异常增加;使用免疫组化技术,同样发现在结肠腺癌 (COAD) 和肺癌患者肿瘤组织中OFD1 的蛋白水平显著高于癌旁组织,提示肿瘤细胞很可能通过提升OFD1的蛋白水平,来维持细胞高速增殖的状态,并抑制了原纤毛的形成。在恶性程度较高的胰腺癌、结肠癌和三阴性乳腺癌的异种移植模型中,靶向OFD1,能显著抑制肿瘤的发生发展。
综上所述,本研究发现了OFD1作为II型成核促进因子的生化活性,也揭示了OFD1调控微丝骨架网络分支动态性的方式和微丝网络的监察机制,该机制的激活决定了正常细胞和肿瘤细胞不同的命运,靶向该监察机制,有望为肿瘤的治疗提供新策略。
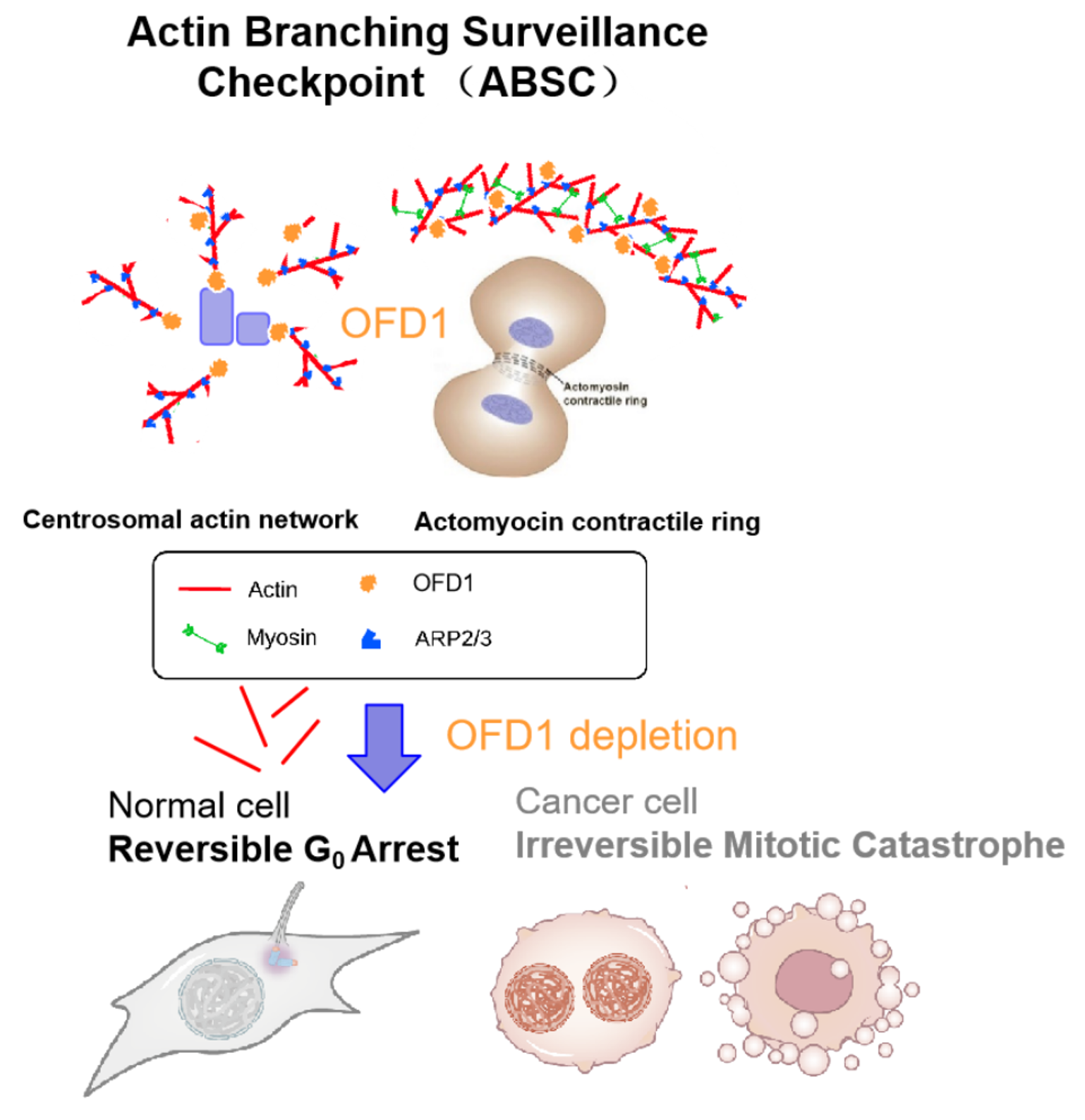
“OFD1介导的中心体微丝网络监察机制”调控模式图
曹木青、邹肖肖和李超怡为论文的共同第一作者,曹木青、汤在明和钟清为论文的通讯作者,林再胜、汪旎、叶幼琼以及美国得州大学西南医学中心的Zhongju Zou、Joachim Seemann、Beth Levine为本文共同作者。清华大学潘俊敏教授、马里兰大学William Snell教授、美国得州大学西南医学中心Saikat Mukhopadhyay教授和Rolf Brekken教授,也对本研究给予了极大的支持。本研究得到了国家自然科学基金项目,国家重点研发计划,上海市学术带头人项目,上海市自然科学基金、上海高水平地方高校创新团队、上海市前沿基地中心、癌基因及相关基因国家重点实验室开放课题等项目资助。
原文链接:https://pubmed.ncbi.nlm.nih.gov/36973243/
参考文献:
1 Nigg, E. A. & Raff, J. W. Centrioles, centrosomes, and cilia in health and disease. Cell 139, 663-678 (2009). https://doi.org:10.1016/j.cell.2009.10.036
2 Rosenbaum, J. L. & Witman, G. B. Intraflagellar transport. Nat Rev Mol Cell Biol 3, 813-825 (2002). https://doi.org:10.1038/nrm952
3 Nigg, E. A. & Stearns, T. The centrosome cycle: Centriole biogenesis, duplication and inherent asymmetries. Nat Cell Biol 13, 1154-1160 (2011). https://doi.org:10.1038/ncb2345
4 Pan, J. & Snell, W. The primary cilium: keeper of the key to cell division. Cell 129, 1255-1257 (2007). https://doi.org:10.1016/j.cell.2007.06.018
5 Li, A. et al. Ciliary transition zone activation of phosphorylated Tctex-1 controls ciliary resorption, S-phase entry and fate of neural progenitors. Nat Cell Biol 13, 402-411 (2011). https://doi.org:10.1038/ncb2218
6 Seeger-Nukpezah, T., Little, J. L., Serzhanova, V. & Golemis, E. A. Cilia and cilia-associated proteins in cancer. Drug Discov Today Dis Mech 10, e135-e142 (2013). https://doi.org:10.1016/j.ddmec.2013.03.004