
|
实验室人员组成: PI:刘俊岭 副教授:孙雪青、党素英 副研究员:樊雪梅、徐艳艳 技术员:张琳 博士后:姜豪杰、孟盼盼 研究生:丁楠、陈琪迪、李琳、杨咪娜、严杰、李果鸣、沈颖芝、王新夏、丁晨、孙惠炎
研究方向及兴趣:
1. 粘附受体介导的信号传导在血小板激活中的作用。
2. 动脉粥样硬化发生发展机制。
3. 基质细胞在肿瘤转移微环境形成中的作用研究。
研究进展:
1. 发现胶原受体GPVI介导的血小板活化新调控机制
胶原受体GPVI作为血小板表面一种重要的粘附受体,能够通过与具有免疫受体酪氨酸活化基序的FcRγ-chain偶联,介导胞内活化信号参与血栓止血、炎症等生理病理过程。从目前的研究结果上看,GPVI活化血小板主要通过以下几个信号转导通路:磷脂酶C(PLC)/PKC通路、磷脂酰肌醇-3激酶(PI3-K)/蛋白激酶B(protein kinase B,Akt)通路、丝裂原激活的蛋白激酶(MAPK)通路等。其中PI3K/Akt通路在GPVI介导的血小板活化中起到了关键性作用。PTEN作为第一个被发现的具有双重特异性磷酸酶活性的肿瘤抑制基因,其不仅有脂质磷酸酶活性,还有蛋白磷酸酶活性,可负性调控三条途径(PI3K/AKT信号通路,粘附斑激酶FAK途径;细胞分裂素激活的蛋白激酶MAPK途径)来调节细胞的生长、增殖、分化、凋亡、粘附和迁移等。但是PTEN在巨核细胞分化以及血小板活化中的功能尚不清楚。我们利用PCR和免疫印迹技术,首次发现PTEN能够在血小板中高表达;通过对造血系特异的PTEN基因敲除小鼠进行表型分析,发现PTEN缺失会促进巨核细胞的分化成熟造成血液中血小板数量明显升高;小鼠尾部出血时间也明显缩短。同时还发现PTEN缺失能够上调胶原引起的血小板聚集和分泌;对胶原受体GPVI介导的血小板活化信号通路进行分析,发现PTEN参与GPVI介导的血小板活化依赖于Src家族激酶,但其调控下游信号分子的机制杂较为复,可以通过PI3K/Akt通路依赖和非依赖两种方式发挥作用。该项研究成果有助于解释血小板增多症以及弥散性血栓的发生机制,并且对非依赖信号通路进行分析,还有可能揭示出一种广泛的全新的PTEN调控模式。该项研究成果发表于2010年10月7日刊的Blood上(Blood. 2010;116(14):2579-81.)。
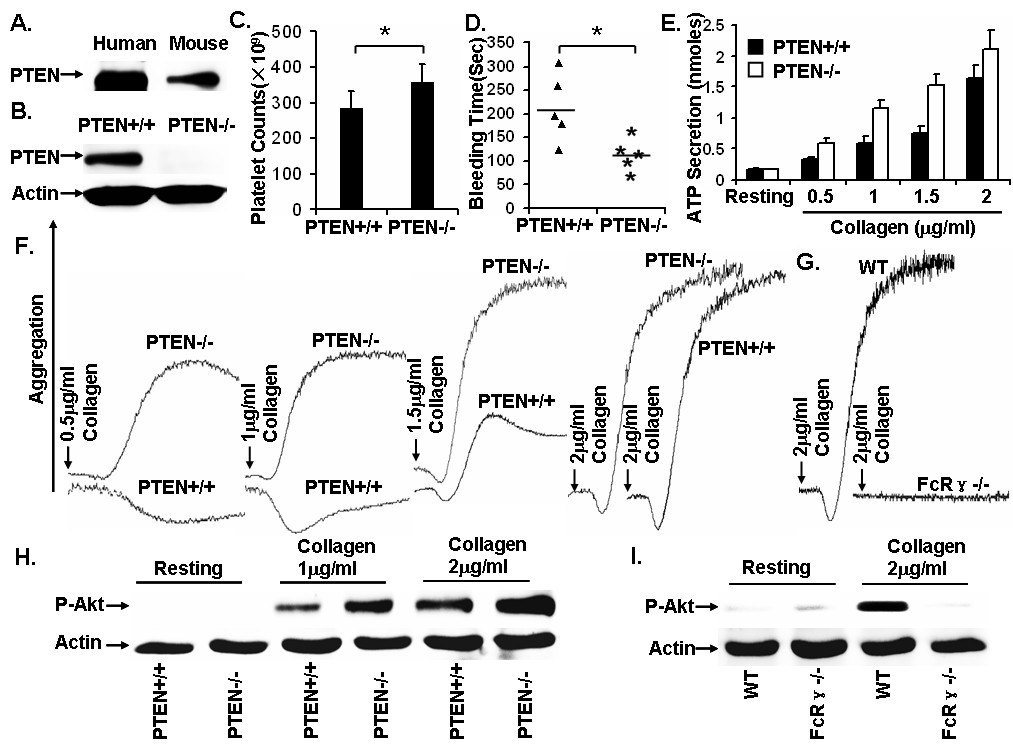
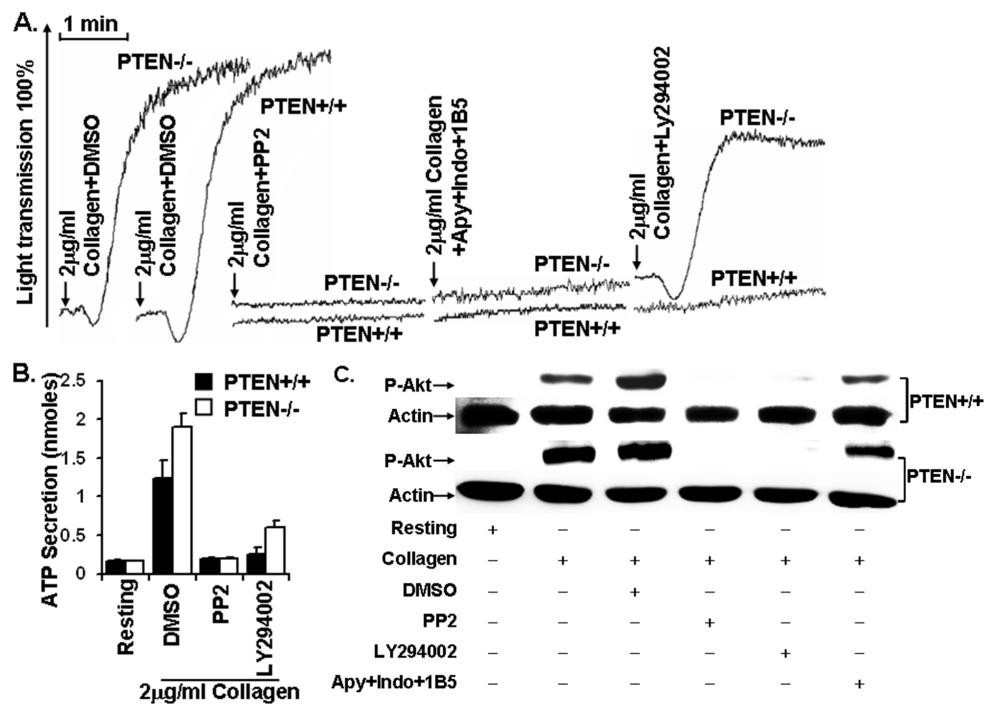
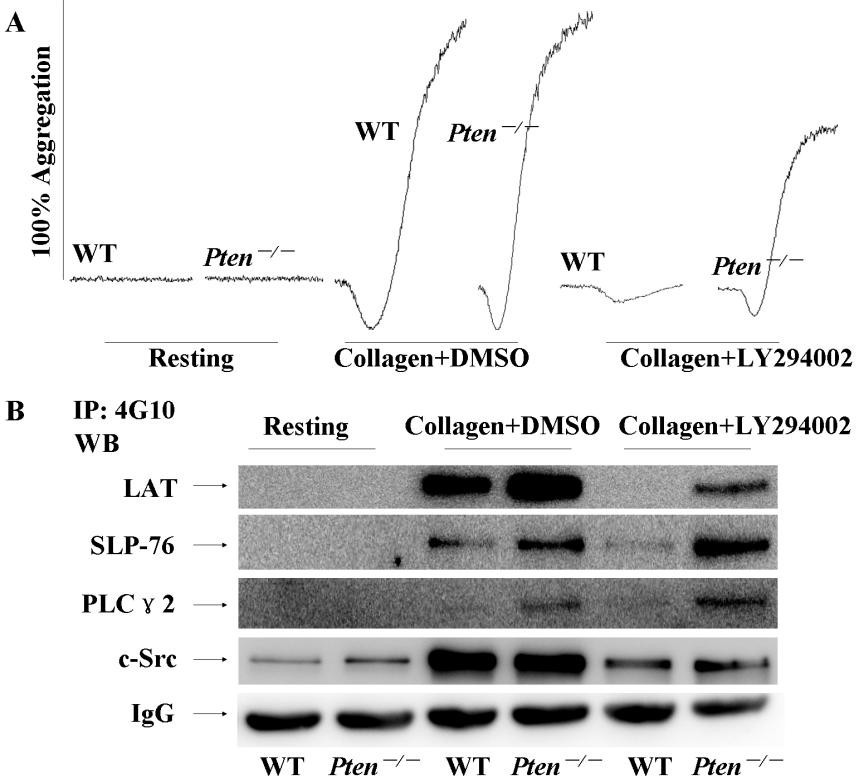
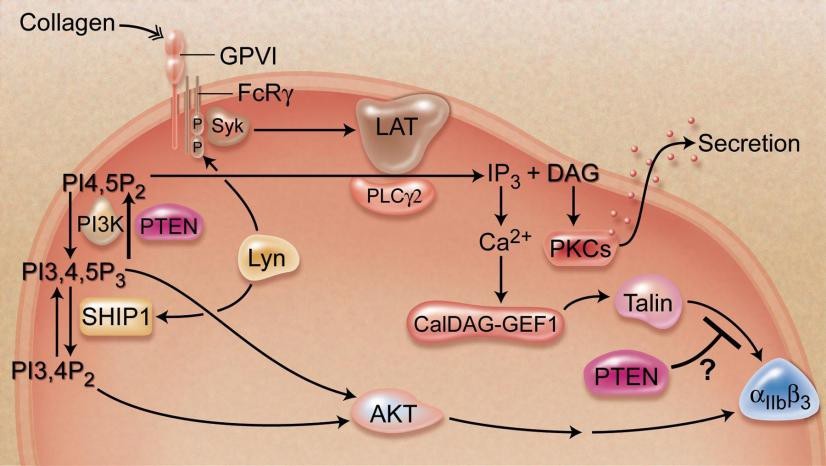
图1 PTEN调节胶原引起的血小板活化的机制。(PTEN: not just a tumor suppressor. Blood, October 7, 2010; 116(14): 2404-5)
GPVI与血小板另一重要受体C-型凝集素样受体2(CLEC-2)通过极为相似的信号途径导致血小板活化,而CLEC-2受体能够与淋巴管特定时段表达的Podoplanin结合活化血小板,这一过程在淋巴管发育过程中极为重要;此外,血小板GPVI介导信号通路又与T细胞受体介导的信号途径极为相似,因而该项研究成果对于阐述PTEN调控淋巴管发育闭合以及T细胞分化成熟的新机制具有重要借鉴作用。有鉴于该发现的重要性,在同期Blood上,编辑高度评价了我们的工作(题为:PTEN: not just a tumor suppressor. Blood, October 7, 2010; 116(14): 2404-5),认为我们发现丰富了血小板活化的分子调控理论,并为研究PTEN的生物学调控机制开创了一个新领域。
2. 血小板P2Y12受体参与肺癌预转移微环境形成的机制研究
动脉粥样硬化是一种慢性炎症性疾病。血小板作为一类重要的血细胞,通过释放炎症因子和表达粘附分子,在粥样硬化斑块部位招募和锚定炎症细胞,因此是动脉粥样硬化恶化发展的重要因素。P2Y12是血小板表面主要的ADP受体,是血小板活化信号的重要放大子,其拮抗剂如氯吡格雷(Clopidogrel,Plavix)和普拉格雷(Prasugrel,Efient,2009年FDA批准上市)在临床被广泛应用于心肌梗死和急性冠脉综合征。大量临床研究表明,服用氯吡格雷后病人血浆中的CD40L,C反应蛋白等与动脉粥样硬化密切相关的多种炎症因子的水平明显下降,这提示我们P2Y12可能在动脉粥样硬化发生发展中起到重要作用。我们利用P2Y12和ApoE基因敲除小鼠高脂饮食模型开展研究,发现P2Y12和ApoE双敲除小鼠的动脉粥样斑块明显小于ApoE敲除小鼠,并且斑块中胶原成分增多,而巨噬细胞浸润减少,同时血浆中血小板为唯一来源的趋化因子PF4的水平明显降低。通过骨髓移植实验进一步证实P2Y12是血小板参与动脉粥样硬化的关键调控因素。在体外实验中,我们发现血小板缺失P2Y12会造成其alpha颗粒释放多种趋化因子的能力以及P-选择素的表达明显受到抑制,血小板趋化单核细胞的能力也相应地减弱。此外,单独使用PKA抑制剂(PKI)就能够直接引起野生型和缺失P2Y12的血小板alpha颗粒释放。因此,我们推断P2Y12通过cAMP-PKA信号通路调控血小板的alpha颗粒中炎性因子如PF4的释放,以及P-selectin表达等,进而调控炎症细胞如单核细胞或巨噬细胞在斑块部位的募集和浸润。我们的研究表明抑制血小板ADP受体P2Y12是预防和治疗动脉粥样硬化的一个新靶点,并为拓展应用氯吡格雷和普拉格雷提供理论依据。我们受邀在美国举行第52届美国血液学年会上(佛罗里达州奥兰多市,2010年12月),作了大会报告(Oral Presentation),汇报了该项研究成果,并且该工作的主要完成人李定博士还获得大会奖励(见附件)。目前,我们已将部分研究结果投递到The Journal of Clinical Investigation杂志进行同行评阅。
3. 发现血小板是肺癌预转移微环境形成中的重要基质细胞
肿瘤转移是导致肿瘤患者死亡的首因,肿瘤转移过程需要形成转移微环境。近来,人们发现肿瘤转移前还会先在靶器官形成由骨髓来源细胞(BMDC)组成的预转移微环境,协助肿瘤细胞转移,预转移微环境的形成机制是目前一个研究热点。血小板参与血栓止血过程,并作为一种重要基质细胞,通过其表面的黏附分子以及α-颗粒释放的活性成分,在肿瘤转移的多个环节上发挥重要作用。血小板是否参与肿瘤预转移微环境的形成,尚无任何文献报道。近来,我们研究发现血小板粘附受体GPIb-IX-V(PNAS 2007;104(21):9024-8.)和GPCR之一P2Y12基因敲除小鼠肺癌转移灶明显少于对照组小鼠;通过免疫组化、荧光分析,发现P2Y12敲除能够抑制VEGFR1+ BMDC细胞在肺部的募集。围绕这些发现,我们将继续利用基因敲除小鼠模型,对血小板多种黏附受体以及α-颗粒释放在肺癌预转移微环境形成中的作用机制展开研究,并考察基于不同作用机制的抗血小板药物对肺癌预转移微环境形成的影响。该项研究有助于理解肿瘤转移病理过程,有助于临床治疗恶性肿瘤。
|
