

实验室成员: PI:李勇 助理研究员:王莹萍 技术员:周洁、朱傲雪 研究生:夏变变、翁维吉、邓琦、张巧、杨洋、向金花、邝宏鹏、顾晓琨
研究方向及兴趣:
研究组以阐述系统相关的膜受体(尤其是负责信息感受和传导的膜受体与离子通道)的内质网质量控制和膜转运过程(包括囊泡蛋白分选、囊泡转运、膜和突触定位及内化再循环过程)调控的分子机制及膜受体转运与重大神经系统疾病发生发展的关系为目标,致力于揭示重要膜受体转运和调控过程的结构基础、蛋白相互作用、调控机制及其生理学功能和病理学意义,探索针对膜受体功能异常的疾病防治策略,对于揭示神经信息传导和突触可塑性具有重要的理论价值。
膜受体定位发生异常可以导致神经和精神疾病,因此研究膜受体转运机理有助于发现新的疾病治疗靶点。目前我们研究组主要针对电压门控钙离子通道和甘氨酸受体的转运调控,借助基因敲除小鼠(SENP1-/-)和前脑高表达甘氨酸受体的转基因小鼠,以细胞生物学、生物化学和电生理技术为主,结合细胞和整体动物水平功能分析等方法,重点研究:甘氨酸受体转运机制、生理学功能及与神经系统疾病的关系;电压门控钙离子通道的转运机制及其与神经信号调控和突触可塑性的关系;神经系统重要膜蛋白化学修饰在神经系统中的作用。
研究进展:
1.蛋白质化学修饰在神经系统中的作用
甘氨酸受体膜转运调节机制
神经元兴奋性是其功能的基础并受控于突触兴奋和抑制的精细平衡调节。 离子型谷氨酸受体和抑制性氨基酸受体(甘氨酸和GABAA受体)在神经元的正确分布、定位和动态调节则是其兴奋性的生化基础,并直接关系到神经信息的正确处理。神经元表面的离子型谷氨酸受体和抑制性氨基酸受体除有组构性插入和内化,同时存在重要的神经元活动依赖性的新增插入或内化对总量和亚型组成进行调节,此即构成了神经元兴奋性和突触效能调节的关键环节。内化的离子型谷氨酸受体和抑制性氨基酸受体根据神经元功能状态需求可以通过再循环重新插入膜表面和突触,或者进入降解途径。离子型谷氨酸受体和抑制性氨基酸受体的上述膜转运过程涉及受体本身膜蛋白的分子内部信号和与多种蛋白质或蛋白质机器复杂和精确的相互作用并可能涉及SUMO特异蛋白酶、激酶、磷酸酶和泛素化酶等一系列调控相关的蛋白。上述细胞生物学过程对于实现神经元兴奋性的稳态平衡和信息处理功能具有特殊重要的意义,阐明有关其细胞分子机制的研究已成为神经科学的一个重要的前沿课题。抑制性突触活动对维持神经系统网络精确的平衡至关重要,系统研究在生理内环境下离子型谷氨酸受体和抑制性氨基酸受体膜转运、定位及动态调节的功能,阐明决定这些蛋白质膜转运过程的结构基础、蛋白质相互作用及其各种修饰调控机制,对于揭示和理解神经兴奋性的稳态平衡的机制具有十分重要的理论价值。也对阐明与此相关的重要神经精神疾病的发病机制及新药靶点的发现具有潜在的应用前景。
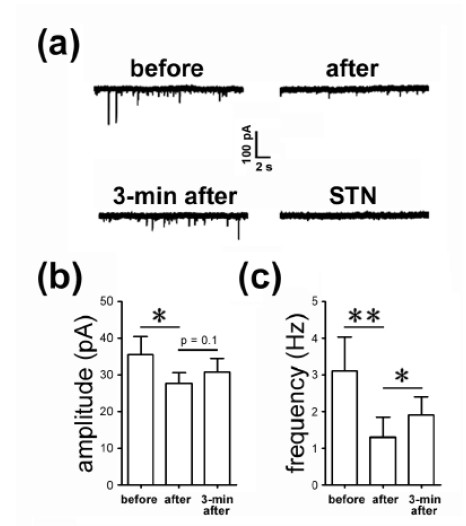
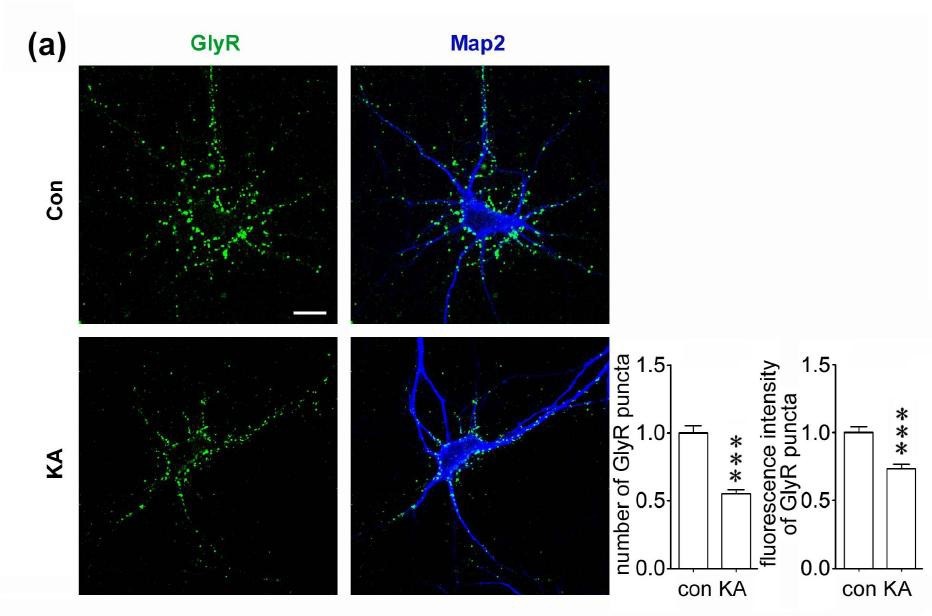
图1 Kainate 受体的激活引起神经元甘氨酸受体的内吞
2.电压依赖离子通道运输的生物学功能和作用机制研究
14-3-3蛋白调控N型钙离子通道(CaV2.2)膜转运及其机制
电压依赖性钙离子通道作为传递钙离子的重要门户,在神经系统精密复杂的病理生理过程中发挥着关键性的作用,N型电压依赖性钙离子通道(CaV2.2),它对于短暂重复的去极化刺激表现出累积性失活特点,这一特性在突触传递的精确性和短时程突触可塑性中起着重要的作用。迄今为止,已发现许多蛋白可以结合并调控CaV2.2,其中14-3-3蛋白是一类高度保守的、所有真核生物细胞中都普遍存在的、在大多数生物物种中由一个基因家族编码的蛋白调控家族,参与生命体许多的生理反应过程,它能与CaV2.2结合并调控其失活动力学特性,但众所周知钙通道本身功能特性的调节并不是决定通道离子通透量的唯一因素,细胞膜表面钙离子通道的数量是另一个关键性的环节,14-3-3蛋白是否参与调节及其如何调控电压依赖性钙通道的膜转运,进而参与突触神经递质的释放和突触可塑性目前仍不清楚。胞内钙信号在机体生命活动中的重要性,使得更深层次的了解电压依赖性钙通道的功能特性及其调控有非同寻常的意义,因此采用tsA201细胞和培养的海马神经元,过量表达14-3-3蛋白的条件下, 研究CaV2.2通道细胞膜表达量的变化及其相关的可能机制。研究发现14-3-3能够促进N-电压依赖性钙离子通道功能亚单位1B在细胞膜表面的功能表达,dynamin 1以及clathrin可能参与了CaV2.2膜转运的调控过程。
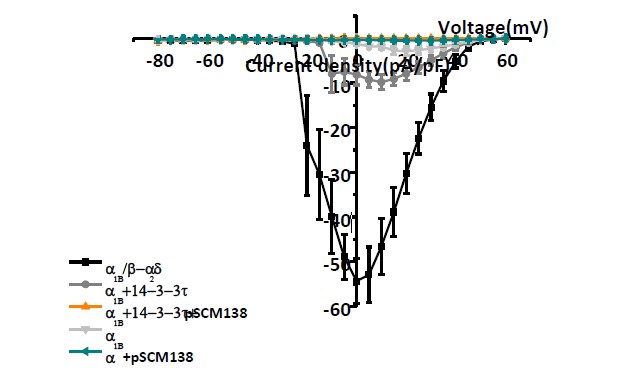
图2 单独转染1B亚基获得的钙电流幅度和密度较共转染14-3-3蛋白组小,将pSCM138与1B或与1B、14-3-3共转染,则基本记录不到电流或仅有很小的钙电流。
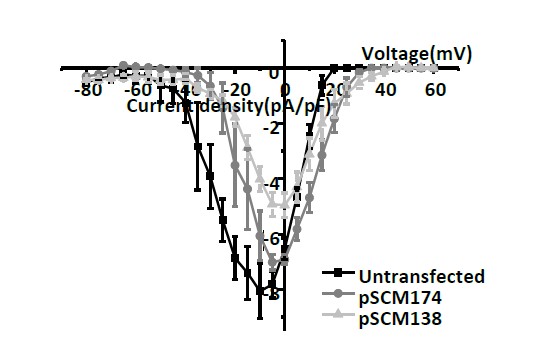
图3 内源性14-3-3蛋白与CaV2.2结合剥离(共转染pSCM138),使其电流幅度/密度降低,而其突变的pSCM174则几乎不影响CaV2.2钙电流幅度/密度。
3.离子型谷氨酸受体的生物学功能研究
KA受体与14-3-3蛋白的关系及其对动力学的影响
KA受体(KAR)是离子型谷氨酸受体的一个亚型,在中枢和外周神经系统有着广泛存在,位于突触前的KAR可以调节抑制性和兴奋性神经递质的释放,位于突触后的KAR可以介导兴奋性突触传递,位在突触外KAR可以调节神经元的兴奋性。在调节神经突触可塑性和神经网络活性起重要作用,并且在病理情况下,像癫痫等疾病的发生中起重要作用。其中KA受体具有介导的EPSC比NMDA受体、AMPA受体的动力学显著减慢的特性,我们的研究发现14-3-3蛋白能够和GluK2相互结合,减慢KA受体的脱敏特性,其可能是神经元KA受体介导EPSC减慢的原因之一。进一步鉴定GluK2与14-3-3蛋白的结合位点和方式,以及在生理条件下对KA受体介导的EPSC的影响正在进展中。
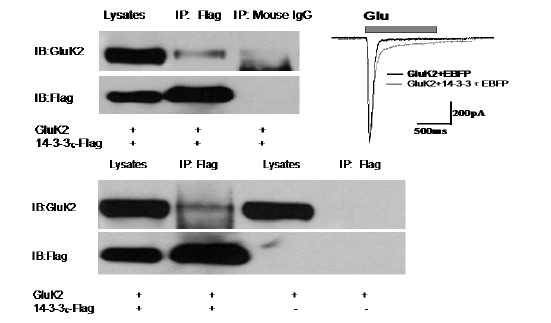
图4 Co-IP检测14-3-3蛋白能够与GluK2结合,并减慢GluK2同聚体的动力学特性
|