
|
实验室人员组成: PI(研究员):余健秀 CO-PI(教授):黄建 副研究员:赵娴 技术员:王艳丽、陈冉 博士后:张海龙、何建锋、郭岩珉、李莲 博士生:刘笑嘉、杨倩倩、黄彩湖、曹滢婷、黄家怡、陆润辉 硕士生:方嘉钰、周子涵、张宇琴、邱丽玲、张雅凡
研究方向:
主要目标是通过细胞系和小鼠动物模型等手段,研究肿瘤发生和转移的新信号通路分子和细胞机制。我们尤其感兴趣的是,肿瘤抑制因子及相关的microRNAs所构成的相互调控网络对一些重要的细胞功能包括细胞凋亡、肿瘤生长抑制和肿瘤转移抑制的作用机理。目前我们有以下几个主要研究方向:
1.肿瘤抑制蛋白修饰与信号传导
我们以前完成的工作表明,多种肿瘤抑制因子构成一个相互调控并高效抑制肿瘤发生、生长及转移的调控网络,这种网络某一环节的中断会加速癌症发展进程。其中肿瘤抑制蛋白质(Egr1、PTEN、p14ARF、p53、p73)的翻译后修饰直接参与这种调控网络的形成。因此,我们正研究这些肿瘤抑制因子的各种蛋白质修饰包括乙酰化、磷酸化、ISG化、SUMO化和泛素化等的作用机制。
2.MicroRNA调控炎症、肿瘤发生发展及转移
癌症是基因组多个基因变异逐渐累积的发生发展过程,其特点是无限制增殖、侵袭和转移。在癌症中,许多分子通路受到影响,涉及到蛋白质编码基因及非编码基因。而细胞内源性的miRNA网络可直接调控多种基因的表达。每一个细胞生理过程均受miRNAs的调节,而一个异常的miRNAs表达谱是多种疾病如癌症等的重要标志。众多的分子生化机制控制着miRNAs的功能,而miRNAs在恶性肿瘤中尤其显得重要。在人体内一些miRNAs基因充当致癌基因,而另一些则是肿瘤抑制基因。miRNAs表达谱可提供独特分析来辨别炎症及肿瘤的起源,特异miRNAs的过度表达或表达不足与临床肿瘤侵袭或转移相关联。因此,准确地评价miRNAs表达变化谱及深入研究miRNA的分子作用机制,可为深入了解炎症及癌症的基本机制提供新手段、新工具。
3.MicroRNA生物合成的关键蛋白质修饰
很多研究发现,肿瘤发生与某些miRNA表达异常存在相关性,在大部分肿瘤中,miRNA整体水平普遍下调,这暗示miRNA生物合成障碍可能是癌症发生的一个重要原因。目前认为miRNA生物合成障碍主要与miRNA的转录后调节失控、在启动子区CpG岛甲基化引起的转录沉默、致癌基因对miRNA转录抑制等有关。而另一种可能的调控机制是miRNA合成途径中的RNA修饰和蛋白质修饰,以及加工复合体中其它蛋白的参与。
miRNA基因由RNA聚合酶II或III的转录成初始miRNAs(Primary miRNAs, pri-miRNA),初始miRNAs经由RNA聚合酶IIIDrosha及其辅助因子DGCR8组成的核微加工复合体(Nuclear microprocessor complex)进一步剪切生成发夹结构的前体miRNA(Precursor miRNA, pre-miRNA)。Pre-miRNAs运输到细胞质中,再经RNA聚合酶Dicer剪切掉miRNA发夹结构的环,从而产生约20-25个核苷酸的短双链RNA。TRBP2是Dicer的一个结合蛋白,具有协同作用。随后双链RNA中间体解开,单链成熟miRNA整合到沉默效应复合体miRNPs中。AGO (Argonaute)是一类小分子RNA结合蛋白,构成基因沉默效应复合体的核心。
课题组在以往工作基础和现有专业技术特色上,针对一些参与miRNA生物合成有关的重要蛋白质DGCR8、TRBP2和AGO2等进行研究。目前,我们发现了一些重要蛋白质化学修饰发生在这些蛋白质上,直接参与调控miRNA的生物合成及加工。我们正进行其主要生物学功能及其相关分子机制的研究,进展良好。
4.肿瘤免疫逃逸
NK细胞(Natural killer cell)也称为自然杀伤细胞,是一种先天免疫性的淋巴细胞,与T淋巴细胞和B淋巴细胞不同,它发挥免疫杀伤作用并不依赖抗体的存在,也不需要预先致敏,而是直接识别靶细胞,如肿瘤细胞和被病毒感染细胞等,通过细胞毒作用和分泌多种细胞因子来杀伤靶细胞,因此是人类免疫系统的“第一道防线”,在机体抗感染和恶性肿瘤免疫监控过程中发挥重要作用,同时也是连接先天免疫与继发免疫的重要纽带。
最近研究表明,miRNA在NK细胞抗感染和恶性肿瘤免疫监视过程中发挥重要作用。但是,对于具体的分子机制仍然不太清晰,如IL-2、IL-15和IL-21等细胞因子处理后miRNA如何调控NK细胞的激活?如何提高NK细胞识别和杀伤靶细胞的效力?到底有哪些miRNA分子参与?这些miRNA又调节了哪些基因?尤其是目前的这些研究大多局限于小鼠NK细胞的miRNA调节,那么人类NK细胞激活的miRNA调节又如何呢?这些问题都有待我们去逐一解决。目前,我们利用小分子RNA高通量深度测序的方法,对静息和激活(IL-2、IL-15和IL-21)的人类NK细胞进行测序,鉴定出在人NK细胞激活的信号传导途径中起关键作用的miRNA分子。
另一方面,我们利用本研究组miRNA慢病毒载体表达库转染P69T/M12T两细胞株,筛选了大量稳定表达miRNA的细胞系。然后,进行NK细胞杀伤活性试验,已发现一些关键miRNAs,可以明显改变肿瘤细胞对NK细胞的杀伤活性。目前,我们正分析这些miRNA调节肿瘤细胞的膜表面受体信号通路及其分子机制。
研究进展:
1. SUMO化修饰介导PTEN膜结合控制肿瘤发生发展的分子机制
仅次于p53基因,肿瘤抑制基因PTEN是一种在人类癌症中最常见易突变的基因。PTEN作为一个非常重要的肿瘤抑制蛋白,能有效拮抗PI3K/AKT信号传导通路而阻止肿瘤发生发展。 PTEN作为一个脂类磷酸酶,能将细胞膜上的PIP3去磷酸化生成PIP2,进而拮抗PI3K介导的细胞生长、代谢、增殖和存活的信号。由于PTEN这一重要性,一直成为细胞生物学、分子生物学、肿瘤学等领域的研究热点,故其功能及作用机制研究得相对较为清楚。PTEN发挥其最主要功能(将PIP3转换成PIP2),必须先结合到细胞膜上,但细胞体内PTEN主要分布在细胞浆和细胞核内。只有某些细胞系在特定条件下被观察到PTEN蛋白转运到细胞膜上。因此,困扰科学家多年的一个科学问题:即在胞浆内的PTEN是如何与定位于细胞膜内侧的底物PIP3发生相互作用的?
在大部分细胞中,PTEN活性的丢失会引起PIP3基础水平的提高,这暗示着在正常情况下PTEN处于一种平衡状态,能保持PIP3基础水平相对低。因此,对此现象只有两种可能的解释:一是胞浆内自由的PTEN能直接结合到细胞膜上,但这种解释与很多现象不符合;另一是存在一个能与细胞膜相结合的“小库”PTEN(遗憾的是,迄今为止还没有直接的证据)。对于后一种解释,仍有许多问题悬而未决。有证据表明,PTEN结合到细胞膜上只需几百毫秒就足于降解几个PIP3分子成为PIP2。而在正常情况下,只有极少部分PTEN动态结合到细胞膜上,这可能是由于PTEN呈特定的蛋白质构象,造成其与细胞膜结合亲和力低。但目前PTEN“膜结合”作用的精确机制仍未十分清楚。我们提出一个PTEN 新作用机制:SUMO1 化修饰直接参与PTEN“膜
结合”。
我们实验室建立了一套很成功的SUMO 化修饰鉴定和功能研究的实验方法体系,因此最近鉴定出PTEN 的一种新型特异修饰,SUMO1 类泛素化(SUMOylation)修饰发生在K266 and K254两个位点上(见图1),这两个位点定位于PTEN 的C2 结构域。我们的初步结果表明这种SUMO1修饰对于PTEN 的肿瘤抑制功能是绝对必须的(图2)。
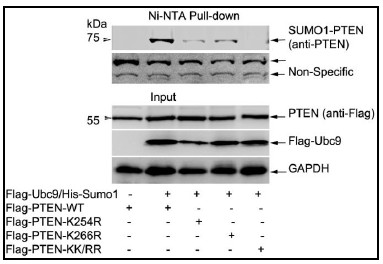
图1. PTEN 在K
266 和K
254 位点上发生SUMO1
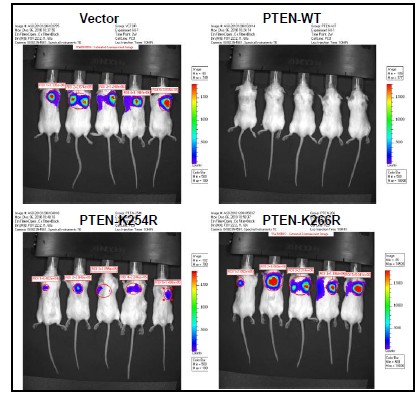
图2. SUMO1 修饰对于PTEN 的肿瘤抑制功能是绝对必须的
我们实验研究表明,这种PTEN 的SUMO1 修饰直接参与了PTEN 与细胞膜内侧的底物PIP3的相互作用。利用计算机分子模拟,将SUMO1 的C -末端甘氨酸羧基与PTEN 的K266 ε-氨基之间形成一个共价异肽键。模型分析表明,SUMO1 与PTEN 共同形成带正电荷的同一界面,可增强与带负电荷的磷脂膜相结合。
图3. 计算机分子模拟一个共价异肽键的连接
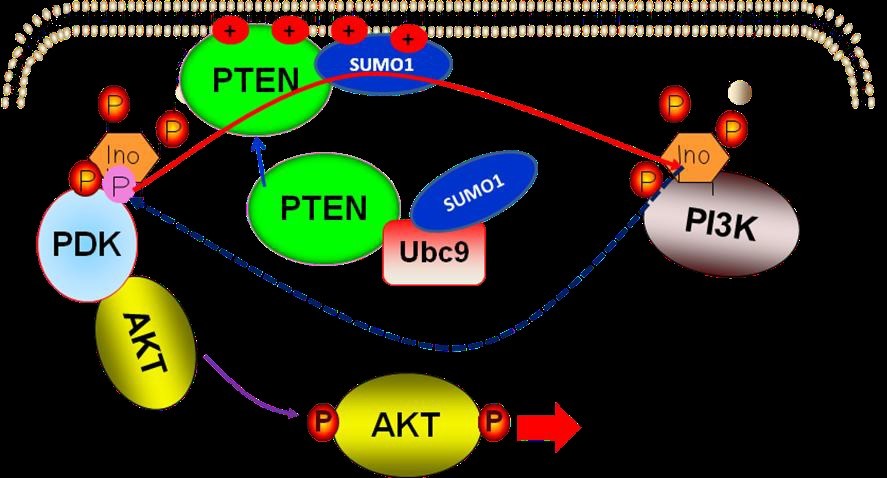
图4. SUMO 化修饰介导PTEN 膜结合调节PI3K-AKT 信号通路模式图
我们提出了一个新的PTEN 作用分子机制:SUMO1 化修饰直接参与PTEN“膜结合”的快速生化反应过程,从本质上解释了PTEN 最重要的作用机理----即PTEN 如何将PIP3 如何转换成PIP2 的精确分子机制,回答PTEN 研究中的最为关键的一个科学问题,即在细胞质胞浆内的PTEN是如何与定位于细胞膜内侧的底物PIP3 发生相互作用 (如图4)。此项研究已投稿于NATURECOMMUNICATIONS,正修回阶段。
另外,关于蛋白质修饰与信号传导,我们还开展了EGR1 蛋白磷酸化修饰、phosphatase类及其相关蛋白(如PTPN11、 GRB2 等)的SUMO 化修饰等的鉴定与功能研究。
2. MicroRNA调控炎症、EMT、肿瘤发生发展及转移
自从第一个microRNA,lin-4,于1993年在线虫发现以来,得益于克隆和测序技术的突破,数量众多的miRNA被发现。在人类基因组中,相对于〜20,000基因而言,已发现1576个miRNAs (按2011年11月 miRBase Release 18公布的),估计会多达2000多个miRNAs基因存在。由约22个核苷酸组成的成熟miRNA,通过DNA甲基化、染色质形成、mRNA降解和蛋白质翻译抑制等多种机制而调节基因的表达。miRNAs与许多重要生物学功能相联系,包括发育时序、细胞分化、细胞增殖、细胞死亡、代谢调控、免疫、病毒防御以及转座子沉默等。miRNAs是基因表达的一种重要调节因子。 癌症是基因组多个基因变异逐渐累积的发生发展过程,其特点是无限制增殖、侵袭和转移。在癌症中,许多分子通路受到影响,涉及到蛋白质编码基因及非编码基因。而细胞内源性的miRNA网络可直接调控多种基因的表达。每一个细胞生理过程均受miRNAs的调节,而一个异常的miRNAs表达谱是多种疾病如癌症等的重要标志。众多的分子生化机制控制着miRNAs的功能,而miRNAs在恶性肿瘤中尤其显得重要。在人体内一些miRNAs基因充当致癌基因,而另一些则是肿瘤抑制基因。miRNAs表达谱可提供独特分析来辨别肿瘤的起源,特异miRNAs的过度表达或表达不足与临床肿瘤侵袭或转移相关联。因此,准确评价一个miRNAs表达变化谱可为深入了解癌症的基本机制提供新手段、新工具。 前列腺癌(Prostate Cancer, PCa)的发病率近年来呈迅速上升趋势。2009年美国前列腺癌占肿瘤新发病例的19%,死亡率仅次于肺癌,居第二位 [American society of clinical oncology: prostate cancer statistics. http://www.cancer.net/prostate]。全球每年约有30万以上男性死于前列腺癌。相比于西方国家的发病率,前列腺癌在亚洲包括我国发病率相对较低。但随着人口老龄化及生活条件的改善,发病率有明显增加的趋势。年纪越大,患前列腺癌的机率就越高。在我国,随着饮食结构的改变及老龄化的进程,前列腺癌的发病率从20世纪60年代的0.48/10万人上升到2000年的3.7/10万人。其中,上海地区前列腺癌发病率上升最为明显,由1995年的3.2/10万人增加到2009年的25/10万人。患前列腺癌的危险因素包括年龄、家庭历史、种族和激素状态等,此外,有说服力的证据表明,环境因素如饮食和生活方式比遗传易感性来说,在前列腺癌变中发挥更加重要的作用。因此需要我们对前列腺癌进行深入的研究。 本研究组多年从事前列腺癌晚期转移的分子机理研究,已建立同一人来源的高度转移与不转移的成对细胞系(M12/P69),经前列腺或腹腔注射裸鼠,M12产生肺部转移而P69不会发生癌细胞转移。M12细胞具有明显EMT转化的特征性标记;3D培养技术分析表明,P69细胞仍以球状物生长而M12细胞则表现为恶性高转移出芽伸展(图5)。我们对这一对细胞系进行了全miRNAs组的深度测序(deep-sequencing),M12和P69两细胞株的小RNA测序均获得了92%以上的有效读本,实际值分别达9698012和11233352。进一步分析表明,这对细胞系的miRNA谱有很大的表达差异性(图6): 两者相同率只为17.13%,M12特异的miRNAs为44.60%, 而P69特异的miRNAs为38.27%。同时,我们还利用新一代高通量测序技术,全面、快速地检测了P69和M12两细胞株的基因表达情况(图7)。我们正根据以上miRNA谱、染色体核型和基因表达谱三方面的结果,解析miRNA、靶基因和目标蛋白之间的分子调控网络。
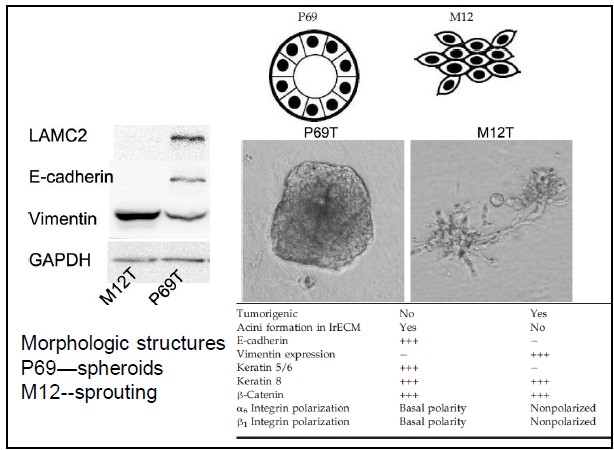
图5. P69T/M12T 两个细胞系在EMT 表型及转移特征的比较(采用3D 培养技术)
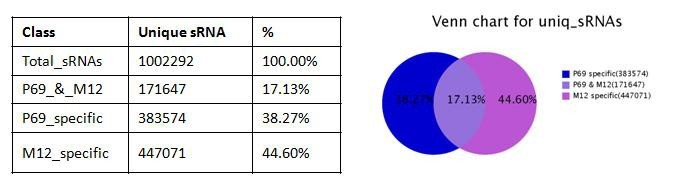
图6. P69/M12 细胞系miRNA 深度测序及该对细胞系的miRNA 谱差异性的比较
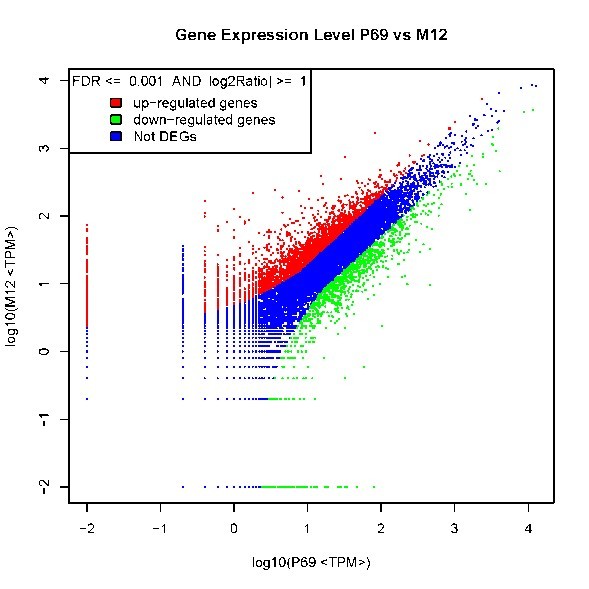
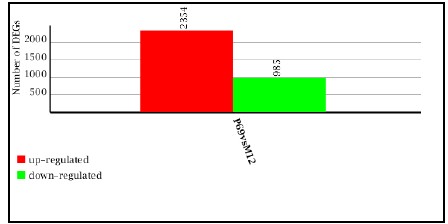
图7. P69/M12差异表达基因(Differentially Expressed Genes, DEGs)
我们利用多种技术 (包括Q-PCR, Northblot, EMSA-gel-shift, Luc-reporter, WB, IP, ELISA, 3D-culture and soft-agar, IF, IHC, xCelligence RTCAadhesion/invasion/migration)鉴定了一个关键microRNA-X。这个miR-X具有促进多种肿瘤细胞(如前列腺癌细胞M12和PC3,及骨肉瘤细胞LM7等)迁移、侵袭。当把此miR-X基因knock-down后,可以完全逆转肿瘤细胞高转移(如图8)。此项工作还正在进行,我们将进一步解析其分子机制及动物肿瘤模型、临床标本分析,完善此项工作。
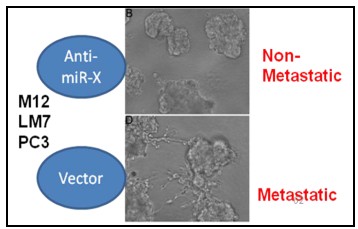
图8. Anti-miR-X逆转恶性高转移肿瘤细胞
3. MicroRNA生物合成的关键蛋白质修饰
很多研究发现,肿瘤发生与某些miRNA表达异常存在相关性,在大部分肿瘤中,miRNA整体水平普遍下调,这暗示miRNA生物合成障碍可能是癌症发生的一个重要原因。目前认为miRNA生物合成障碍主要与miRNA的转录后调节失控、在启动子区CpG岛甲基化引起的转录沉默、致癌基因对miRNA转录抑制等有关。而另一种可能的调控机制是miRNA合成途径中的RNA修饰和蛋白质修饰,以及加工复合体中其它蛋白的参与。 miRNA基因由RNA聚合酶II或III的转录成初始miRNAs(Primary miRNAs, pri-miRNA),初始miRNAs经由RNA聚合酶III Drosha及其辅助因子DGCR8组成的核微加工复合体(Nuclear microprocessor complex)进一步剪切生成发夹结构的前体miRNA(Precursor miRNA, pre-miRNA)。Pre-miRNAs运输到细胞质中,再经RNA聚合酶Dicer剪切掉miRNA发夹结构的环,从而产生约20-25个核苷酸的短双链RNA。TRBP2是Dicer的一个结合蛋白,具有协同作用。随后双链RNA中间体解开,单链成熟miRNA整合到沉默效应复合体miRNPs中。AGO (Argonaute)是一类小分子RNA结合蛋白,构成基因沉默效应复合体的核心(17-18)。 我们课题组在以往工作基础和现有专业技术特色上,针对一些参与miRNA生物合成有关的重要蛋白质DGCR8、TRBP2和AGO2等进行研究。目前,我们发现了一些重要蛋白质化学修饰发生在这些蛋白质上,直接参与调控miRNA的生物合成及加工。我们正进行其主要生物学功能及其相关分子机制的研究,进展良好。
4. 肿瘤免疫逃逸
NK细胞(Natural killer cell)也称为自然杀伤细胞,是一种先天免疫性的淋巴细胞,与T淋巴细胞和B淋巴细胞不同,它发挥免疫杀伤作用并不依赖抗体的存在,也不需要预先致敏,而是直接识别靶细胞,如肿瘤细胞和被病毒感染细胞等,通过细胞毒作用和分泌多种细胞因子来杀伤靶细胞,因此是人类免疫系统的“第一道防线”,在机体抗感染和恶性肿瘤免疫监控过程中发挥重要作用,同时也是连接先天免疫与继发免疫的重要纽带。 最近研究表明,miRNA在NK细胞抗感染和恶性肿瘤免疫监视过程中发挥重要作用。但是,对于具体的分子机制仍然不太清晰,如IL-2、IL-15和IL-21等细胞因子处理后miRNA如何调控NK细胞的激活?如何提高NK细胞识别和杀伤靶细胞的效力?到底有哪些miRNA分子参与?这些miRNA又调节了哪些基因?尤其是目前的这些研究大多局限于小鼠NK细胞的miRNA调节,那么人类NK细胞激活的miRNA调节又如何呢?这些问题都有待我们去逐一解决。目前,我们利用小分子RNA高通量深度测序的方法,对静息和激活(IL-2、IL-15和IL-21)的人类NK细胞进行测序,鉴定出在人NK细胞激活的信号传导途径中起关键作用的miRNA分子,该项研究已投稿。 另一方面,我们利用本研究组miRNA慢病毒载体表达库转染P69T/M12T两细胞株,筛选了大量稳定表达miRNA的细胞系。然后,进行NK细胞杀伤活性试验,已发现一些关键miRNAs,可以明显改变肿瘤细胞对NK细胞的杀伤活性。目前,我们正分析这些miRNA调节肿瘤细胞的膜表面受体信号通路及其分子机制。
近期代表性成果简介:
发现SUMO化修饰介导PTEN膜结合控制肿瘤发生发展的分子机制仅次于p53基因,肿瘤抑制基因PTEN是一种在人类癌症中最常见易突变的基因。PTEN作为一个非常重要的肿瘤抑制蛋白,能有效拮抗PI3K/AKT信号传导通路而阻止肿瘤发生发展。
PTEN作为一个脂类磷酸酶,能将细胞膜上的PIP3去磷酸化生成PIP2,进而拮抗PI3K介导的细胞生长、代谢、增殖和存活的信号。由于PTEN这一重要性,一直成为细胞生物学、分子生物学、肿瘤学等领域的研究热点,故其功能及作用机制研究得相对较为清楚。PTEN发挥其最主要功能(将PIP3转换成PIP2),必须先结合到细胞膜上,但细胞体内PTEN主要分布在细胞浆和细胞核内。只有某些细胞系在特定条件下被观察到PTEN蛋白转运到细胞膜上。因此,多年来有一个关键科学问题一直困扰着科学家:即在胞浆内的PTEN是如何与定位于细胞膜内侧的底物PIP3发生相互作用?
我们最近鉴定出PTEN蛋白一种新型特异修饰,即SUMO1类泛素化(SUMOylation)修饰,发生在K266 and K254两个位点上,这两个位点刚好定位于PTEN的C2结构域。研究结果表明SUMO1修饰对于PTEN的肿瘤抑制功能是绝对必须的,而且这种修饰直接参与了PTEN与细胞膜内侧的底物PIP3的相互作用。据此,我们提出了一个新的PTEN作用分子机制:即SUMO1化修饰直接介导PTEN膜结合并快速地将PIP3转换成PIP2,进而抑制了PI3K-AKT信号通路及肿瘤的发生发展(如图1)。我们的研究回答了PTEN分子作用机制研究中最为关键的一个科学问题,即在细胞质胞浆内的PTEN是如何与定位于细胞膜内侧的底物PIP3发生相互作用的分子机制。相关论文发表在Nature Communications(2012),并立即被Faculty of 1000推荐与高度好评 “The data from Huang and co-workers indicate that the lipid phosphatase and tumour suppressor phosphatase andtensin homologue (PTEN) must have a SUMO protein modification in order to access its lipid substrate and inhibitcell proliferation. This may require a reinterpretation of several previous studies of PTEN, but could also shed newlight on the roles in cancer of SUMO-modifying enzymes and SUMO1/sentrin-specific protease 1 (SENP1) inparticular.”。美国Johns Hopkins 大学Michael J. Matunis 教授为我们的文章专门写了一篇综述(Matunis MJ, Guzzo CM, 2012),并作出高度评价“Recent work by Huang and colleagues sheds new light on the mechanisms regulating PTEN association with the plasma membrane (Huang et al., 2012)”
|
