
孤独症谱系障碍(Autism Spectrum Disorder),又称自闭症,是一类严重影响儿童身心健康的神经发育疾病,患者表现出严重程度不同的社交障碍以及重复刻板行为。根据美国疾控中心统计,孤独症的发病率呈现逐年升高的趋势,最新的2022年美国孤独症患病率约为1/361。中国对于6~12岁孤独症儿童患病率的统计显示,男孩约为0.44%~0.95%,女孩约为0.12%~0.30%2。遗传因素是孤独症致病的最主要因素,近年来研究者们发现了大量的孤独症风险基因及致病基因突变3,4,目前研究多集中在基因突变导致孤独症的分子与环路机制上,是否可以运用基因编辑方法对导致孤独症的基因突变在大脑内进行准确的修复还未见报道。
2023年11月27日,上海交通大学医学院松江研究院/中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)仇子龙团队与复旦大学脑科学转化研究院程田林团队合作在国际神经科学权威期刊Nature Neuroscience杂志上发表题为Whole-brain in vivo base editing reverses behavioral changes in Mef2c mutant mice的研究论文,首次报道了在全脑范围内利用单碱基编辑技术成功改善Mef2c孤独症小鼠模型神经发育与孤独症样核心行为表型。
仇子龙研究团队通过全外显子组测序技术在一例中国的孤独症患儿的MEF2C基因上发现了一个新发点突变(de novo mutation), c.T104C, p.L35P, MEF2C基因已被证实是一个很重要的孤独症风险基因,突变会导致神经发育迟滞及一系列严重症状5,但是该新发点突变对于MEF2C基因功能的影响未知。研究团队首先利用分子细胞生物学的研究方法在体外探究了 L35P 点突变对 MEF2C 蛋白结构、表达以及功能上的影响及其分子机制 (图I和图II)。 研究团队发现 L35P 突变会导致 MEF2C 蛋白质发生依赖泛素化蛋白酶体途径的快速降解(图II),最终显著降低MEF2C蛋白的表达水平(图I)。
为了研究 L35P 基因突变对小鼠行为学表型的影响,研究团队构建了Mef2c L35P 点突变敲入小鼠模型,并通过生物化学、免疫荧光成像以及行为学实验探究了其神经发育及行为学表型。研究发现Mef2c L35P 杂合突变小鼠大脑中存在孤独症相关的神经生理学特征以及发育异常现象,并且表现出社交障碍以及刻板行为等孤独症核心症状的行为学表型(图III)。
随后,为了修复小鼠大脑神经元中的L35P点突变,仇子龙和程田林团队合作开发了一种基于CRISPR/Cas9 的新型胞嘧啶单碱基编辑系统(APOBEC3A embedding Cytosine Base Editor,AeCBE,已申请相关发明专利),使其能够将小鼠Mef2c基因中特定位置上异常的C·G碱基对转换成正常的T·A碱基对。为了能够使得新型CBE系统成功地跨越小鼠血脑屏障(blood brain barrier, BBB),研究团队将AeCBE系统包装进PHP.eB血清型的腺相关病毒(Adeno-associated virus,AAV)中,并且利用单次小鼠尾静脉注射AAV的递送方式,使得AeCBE系统在小鼠大脑中多个脑区得以成功表达。经AeCBE系统编辑后,研究团队在体内检测到较高的单碱基编辑效率以及低脱靶事件,验证了新开发的AeCBE系统具备高效性、准确性且安全性的特点(图IV)。
最后,研究团队检测了经过AeCBE系统介导的基因治疗后Mef2c L35P突变杂合小鼠大脑中的神经生理学变化以及行为学表型。在经过单碱基编辑技术介导的基因修复后,研究团队发现Mef2c L35P突变杂合小鼠大脑中降低的Mef2c蛋白表达水平得到恢复,并且其社交障碍以及重复刻板性行为也得到了明显的改善。
本工作提出了利用具有自主知识产权的单碱基编辑系统在全脑水平修复单核苷酸致病突变的体内基因编辑策略,为设计神经遗传疾病的基因编辑干预治疗方案提供了全新思路。
上海交通大学医学院松江研究院/中国科学院脑智卓越中心仇子龙研究员和复旦大学脑科学转化研究院程田林研究员为该论文共同通讯作者。中国科学院脑智卓越中心李维克博士,复旦大学脑科学转化研究院博士生张淑倩为该论文共同第一作者。中国科学院脑智卓越中心彭婉玲、石玉含、袁博、袁依婷、王锦程、韩文建、陈枝芳、单仕芳、上海交通大学医学院附属第九人民医院薛震宇、复旦大学脑科学转化研究院陈金龙、张成以及复旦大学脑科学研究院薛碧清对该工作做出重要贡献。该研究工作得到了中国科学院脑智卓越中心许晓鸿研究员、竺淑佳研究员、临港实验室徐华泰研究员和复旦大学脑科学研究院邰一琳研究员的重要指导。该研究工作还得到了中国科学院脑智卓越中心分子细胞平台,实验动物平台与光学成像平台大力支持。
上海交通大学医学院松江研究院仇子龙研究员实验室(https://www.shsmu.edu.cn/sri/kxyj/yjdw1/js/czl.htm)长期致力于孤独症的神经生物学研究工作,从孤独症的遗传学分析、神经发育机制、分子神经生物学与基因编辑干预等方面开展工作,长期招收相关专业博士后,请有志学子与仇子龙研究员直接联系(qiuzilong@shsmu.edu.cn)。
复旦大学脑科学转化研究院程田林研究员实验室(https://itbr.fudan.edu.cn/info/1202/1805.htm)致力于基因编辑技术研发及各类遗传病基因治疗研究,长期招收相关专业博士后,请有志学子与程田林研究员直接联系(chengtianlin@fudan.edu.cn)。
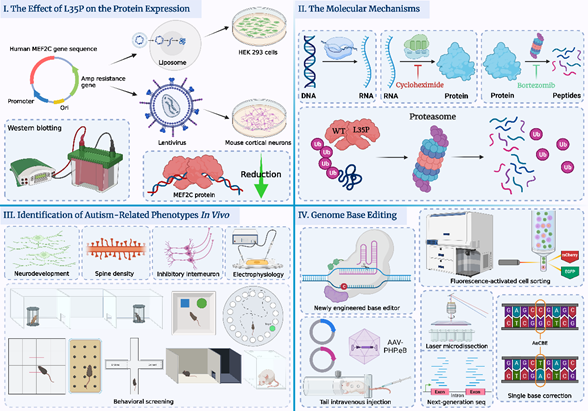
图I: L35P点突变显著降低MEF2C蛋白表达水平。
图II:L35P点突变通过泛素化蛋白酶体降解途径介导MEF2C蛋白翻译后快速降解。
图III:Mef2c L35P杂合小鼠表现出与孤独症相关的异常神经发育,突触密度降低,抑制性中间神经元数量下降及异常的电生理表型,且出现孤独症相关的行为学表型。
图IV: 基于CRISPR/Cas9系统开发的新型胞嘧啶单碱基编辑系统,通过体内及体外验证了其在目标靶点的碱基编辑效率以及脱靶事件,证明该系统是高效,准确且安全的。
原文链接:
https://www.nature.com/articles/s41593-023-01499-x
参考文献
1.Maenner, M. J. et al. Prevalence and Characteristics of Autism Spectrum Disorder Among Children Aged 8 Years - Autism and Developmental Disabilities Monitoring Network, 11 Sites, United States, 2020. MMWR Surveill Summ 72, 1-14 (2023). https://doi.org:10.15585/mmwr.ss7202a1
2.Zhou, H. et al. Prevalence of Autism Spectrum Disorder in China: A Nationwide Multi-center Population-based Study Among Children Aged 6 to 12 Years. Neurosci Bull 36, 961-971 (2020). https://doi.org:10.1007/s12264-020-00530-6
3.Geschwind, D. H. & Flint, J. Genetics and genomics of psychiatric disease. Science 349, 1489-1494 (2015). https://doi.org:10.1126/science.aaa8954
4.Sanders, S. J. et al. De novo mutations revealed by whole-exome sequencing are strongly associated with autism. Nature 485, 237-241 (2012). https://doi.org:10.1038/nature10945
5.Parikshak, N. N. et al. Integrative functional genomic analyses implicate specific molecular pathways and circuits in autism. Cell 155, 1008-1021 (2013). https://doi.org:10.1016/j.cell.2013.10.031
同行专家评论:牛煦然博士,魏文胜教授(北京大学)
孤独症谱系障碍(Autism spectrum disorder, ASD)(亦称“自闭症”)是一类神经发育障碍性疾病,患者往往有社交、语言等方面的障碍,并会存在重复刻板的行为。随着1988年著名电影Rain Man的上映,这一疾病更加为人所知。目前,ASD已被明确报道存在高度遗传倾向。在包括中国和韩国在内的东亚ASD人群队列研究中,MEF2C这一基因的突变已经被发现和ASD发病相关。MEF2C在小鼠神经元分化、神经发育和突触可塑性中发挥着重要作用,暗示这一基因可能通过影响神经系统发育而产生ASD疾病表型。
近日,上海交通大学医学院松江研究院/中科院脑智卓越中心仇子龙课题组与复旦大学脑科学转化研究院程田林课题组合作在Nature Neuroscience上发表了题为Whole-brain in vivo base editing reverses behavioral changes in Mef2c mutant mice的研究论文。该文章通过全外显子组测序在患者中发现了MEF2C基因上的一个de novo SNV(c.104T > C, p.L35P),并证实了该突变会影响MEF2C的泛素化降解途径进而影响蛋白水平。MEF2C-L35P敲入的杂合小鼠会出现明显的新事物识别障碍、多动、重复行为等ASD表型。由于该突变恰好可以被胞嘧啶碱基编辑器CBE所纠正,因此研究人员使用优化的APOBEC内嵌型CBE(AeCBE)结合双AAV递送的方式对Mef2c L35P+/-小鼠进行了in vivo基因编辑治疗,成功纠正了小鼠所存在的类ASD疾病表型。
本论文可圈可点之处,第一是在小鼠上精确模拟了人群中存在的SNV并得到了相似的ASD表型,为进一步的研究提供了良好的模型基础;第二是使用优化的AeCBE进行编辑,不仅比AncBE4等编辑器效率更高,还使用了PAM为NGN的SpG Cas9,拓宽了编辑器的使用范围;第三是使用了可以突破血脑屏障的AAV-PHP.eB,高效地将编辑系统递送至小鼠全脑;第四是概念上证明了碱基编辑器可以通过一次给药的方式,对脑部遗传疾病进行精准且有效的基因治疗,为未来ASD及相关遗传疾病治疗提供了良好的思路与范式。近期,仇子龙课题组还和上海交通大学医学院附属新华医院李斐团队报道了中国孤独症人群的大规模全外显子遗传学研究。研究中所鉴定的多个高置信度的ASD候选基因及对应的相关突变都有使用相似策略进行研究和治疗的价值。在今年3月,David Liu课题组也在Science上发文,使用双AAV9载体递送ABE编辑系统对脊髓型肌萎缩症(SMA)小鼠进行了治疗。该策略主要针对脊髓运动神经元,同样可以实现一次给药,终身治愈的目的。
当然在未来,对于脑部遗传病的基因治疗还可以有更多优化选择策略,比如针对需编辑的致病位点多样性,可以选择不同PAM的Cas9进一步拓宽使用范围;可以使用AAV-PHP.eB进一步优化得到的AAV.CAP-B10血清型进行更为高效精准的神经元递送,或针对具体需求使用AAV-MG1.2等更加亲和小胶质细胞的血清型进行递送。除CBE之外,ABE编辑系统以及近期报道的多个基于ABE系统TadA脱氨酶进化得到的新型CBE、CGBE、ACBE等编辑工具均有望在遗传疾病的治疗中得到应用。基于ABE系统的编辑器整体安全性(包括脱靶效应在内)比CBE更好,且有的变体具有良好的A5、C5等位置的窄窗口编辑效果,对于以治疗为目的精准编辑更为有利。与此同时,由于ABE的整体系统更小,可以包装入单个AAV内,因此ABE系统和如直接进化TadA所得到的TadCBEs工具也有极大的in vivo基因治疗潜力。
或许在未来,我们身边的Rain Man,可以在飞速发展的基因编辑工具的应用浪潮中,拥有Healthy Brain,成为走出孤独世界的Brave Man。
同行专家评论:李大力教授(华东师范大学)
人类致病性遗传突变中有近6成为点突变,虽然基于CRISPR的HDR技术提供了碱基突变修复的可操作性,但受外源模板、修复机制等影响,HDR的编辑效率仍非常有限。此外,HDR介导的基因编辑往往依赖于细胞分裂,其应用潜力更加受限。近年来, CRISPR衍生技术-碱基编辑器(BE)已成为广受欢迎的碱基高效替换工具,它主要由Cas蛋白与脱氨酶或DNA损伤修复酶构成,如CBE, ABE, CGBE/GBE 以及最近开发的腺嘌呤颠换编辑器(AYBE, AXBE, ACBE)等。因无需依赖外源模板和DSB,理论上也不依赖于细胞分裂,碱基编辑技术已广泛应用于生命科学的众多领域,特别是基于血红蛋白病、早衰症、视网膜病变、神经肌肉病、心肌病、耳聋等疾病的基因治疗。
遗传变异是导致多种神经系统疾病发生的关键因素,因此能精准修复致病突变的基因编辑技术在其中的治疗潜力也广受关注。考虑到神经元在出生后很快失去分裂能力的特点,BE较HDR在神经系统疾病治疗中更具有应用的潜力和可行性,但BE是否真能用于逆转大脑的致病突变而治疗神经发育障碍疾病(如自闭症),目前尚未有相关报道。
近期发表在Nature Neuroscience的工作中,仇子龙和程田林团队合作首次鉴定了一个诱发自闭症的罕见致病点突变(c.104T>C, p.L35P),该位点位于MEF2C基因MADS结构域上,对于维持MEF2C蛋白稳定性以及神经元发育非常重要。研究者还发现,携带该致病点突变的小鼠中也出现了神经发育异常和自闭症样的行为表型,表明成功获得了自闭症疾病模型。为实现该致病位点的有效纠正,作者结合Cas9广谱突变体SpG、脱氨酶APOBEC3A的高安全性突变体以及内部嵌入策略,开发出了新型CBE工具-AeCBE。通过与经典的CBE进行对比,作者发现AeCBE在含有致病突变的小鼠原代皮层神经元中具有最优的胞嘧啶转换编辑效率,证实了碱基编辑器用于非分裂细胞神经元致病突变修复的可行性。最后使用内含肽介导的拆分策略以及穿过血脑屏障(BBB)的AAV-PHPeB系统进行体内递送,发现AeCBE在全脑Mef2c产生了高效的C-to-T编辑(~20%)且具有较低的脱靶风险。该治疗能有效恢复Mef2c蛋白的表达水平,并有效改善了自闭症小鼠的突触功能和社交能力,也显著降低了重复刻板行为的出现。
总之,这项工作发现了导致自闭症的MEF2C致病新突变,探索了新突变的致病机理,还创新性开发出高效且更少旁观者突变的AeCBE系统,最终通过在体全脑碱基编辑首次实现了自闭症小鼠的有效治疗。该研究为自闭症治疗提供了新的思路,并进一步表明了碱基编辑技术治疗遗传性脑部疾病的巨大潜力。
同行专家评论:朱俊杰博士、陈佳研究员(上海科技大学)
自闭症谱系障碍(ASD)是一种具有高度遗传性的神经发育障碍,表现为社交缺陷,以及重复或受限的行为1,2。目前为止,美国食品药品监督管理局(FDA)已批准使用一些非典型抗精神病药物治疗自闭症患者,例如利培酮(Risperdal)和阿立哌唑(Abilify),但往往伴随着一些副作用。
有研究结果表明,MEF2C基因在成年小鼠的大脑皮质、海马体和杏仁核中大量表达3,其能够调节突触可塑性和谷氨酸能突触的数量,是ASD相关基因网络的调节基因之一4。MEF2C的突变会导致儿童大脑发育缺陷,其特征为精神运动障碍,缺乏言语,异常运动模式等5,6。
基于CRISPR/Cas9的基因编辑系统已被广泛应用于研究和治疗各种遗传疾病,如遗传性转甲状腺素淀粉样变性(hATTR)7、遗传性血管性水肿(HAE)、阿尔兹海默症(AD)8和亨廷顿舞蹈症(HD)9等。但碱基编辑仍没有得到广泛应用,尤其在神经发育障碍治疗领域。
仇子龙/程田林团队在最新发表的论文 Whole-brain in vivo base editing reverses behavioral changes in Mef2c mutant mice,为遗传性神经发育障碍的治疗提供了新的思路。研究团队首先在ASD患者中鉴定出MEF2C基因中一种新的SNV(c.104T>C, p.L35P),构建了Mef2c L35P+/-自闭症谱系障碍小鼠模型,并进一步研究Mef2c L35P突变对小鼠的影响。为了纠正这一突变,研究团队在SpG蛋白内部融合了人胞苷脱氨酶APOBEC3A-Y130F10和尿嘧啶糖苷酶抑制剂(UGI),从而构建了一种新的CBE工具- AeCBE。其具有编辑效率高,旁观者编辑(bystander)和脱靶编辑(off-target editing)低等优点。随后,作者们采用可穿过血脑屏障的双AAV系统(AAV-PHP.eB)和内含肽介导的拆分策略,将AeCBE系统递送至Mef2c L35P+/-小鼠模型中。通过NGS、免疫染色、行为学分析,电生理等手段,验证了AeCBE能够在小鼠模型中高效编辑靶向位点,并纠正Mef2c L35P+/-小鼠的自闭症行为。
目前,自闭症的治疗是医学中的难点之一,尚没有特效药能够治疗自闭症。而在本研究中,作者们在前期报道的hA3A-BE3-Y130F碱基编辑器的基础上构建了一种新的CBE系统,能够在ASD小鼠模型中纠正MEF2C(c.104T>C)点突变,并纠正其自闭症行为。虽然ASD的成因极其复杂,但这项研究证明了体内碱基编辑在神经发育障碍治疗中的潜力,同时也为其他类型的碱基编辑器在脑内递送以及编辑带来了新的启发。
1 Colvert, E. et al. Heritability of Autism Spectrum Disorder in a UK Population-Based Twin Sample. JAMA Psychiatry 72, 415-423 (2015). https://doi.org:10.1001/jamapsychiatry.2014.3028
2 Geschwind, D. H. & Flint, J. Genetics and genomics of psychiatric disease. Science 349, 1489-1494 (2015). https://doi.org:10.1126/science.aaa8954
3 Leifer, D. et al. MEF2C, a MADS/MEF2-family transcription factor expressed in a laminar distribution in cerebral cortex. Proc Natl Acad Sci U S A 90, 1546-1550 (1993). https://doi.org:10.1073/pnas.90.4.1546
4 Parikshak, N. N. et al. Integrative functional genomic analyses implicate specific molecular pathways and circuits in autism. Cell 155, 1008-1021 (2013). https://doi.org:10.1016/j.cell.2013.10.031
5 Cardoso, C. et al. Periventricular heterotopia, mental retardation, and epilepsy associated with 5q14.3-q15 deletion. Neurology 72, 784-792 (2009). https://doi.org:10.1212/01.wnl.0000336339.08878.2d
6 Wright, C. F. et al. Non-coding region variants upstream of MEF2C cause severe developmental disorder through three distinct loss-of-function mechanisms. Am J Hum Genet 108, 1083-1094 (2021). https://doi.org:10.1016/j.ajhg.2021.04.025
7 Gillmore, J. D. et al. CRISPR-Cas9 In Vivo Gene Editing for Transthyretin Amyloidosis. N Engl J Med 385, 493-502 (2021). https://doi.org:10.1056/NEJMoa2107454
8 György, B. et al. CRISPR/Cas9 Mediated Disruption of the Swedish APP Allele as a Therapeutic Approach for Early-Onset Alzheimer's Disease. Mol Ther Nucleic Acids 11, 429-440 (2018). https://doi.org:10.1016/j.omtn.2018.03.007
9 Yang, S. et al. CRISPR/Cas9-mediated gene editing ameliorates neurotoxicity in mouse model of Huntington's disease. J Clin Invest 127, 2719-2724 (2017). https://doi.org:10.1172/jci92087
10 Wang, X. et al. Efficient base editing in methylated regions with a human APOBEC3A-Cas9 fusion. Nature Biotechnology 36, 946-949 (2018). https://doi.org:10.1038/nbt.4198
