2026年1月9日,上海交通大学医学院上海市免疫学研究所Svetoslav Chakarov研究员领衔联合国内外合作团队,在Nature immunology上发表了题为Temporal and spatial atlas of eosinophil specialization across tissues的资源论文,该研究首次确立了“组织驻留时长” 是嗜酸性粒细胞成熟进程、亚群异质性和功能特化的核心调控维度,从根本上革新了学界对嗜酸性粒细胞生物学的理论认知。为揭示这一原则,研究团队创新性地整合了单细胞转录组测序、高维表面蛋白组分析和体内谱系示踪等技术,成功构建了首个跨组织嗜酸性粒细胞动态发育图谱。该图谱首次实现了对嗜酸性粒细胞从骨髓发育、外周循环、组织定植到功能分化的全生命周期时空动态解析,为深入理解这一重要免疫细胞群体的生物学特性提供了系统性的研究工具和理论框架。
嗜酸性粒细胞是多功能粒细胞,在免疫调节、代谢平衡和组织修复等过程中发挥重要作用,然而其功能特化的调控机制仍不明确。
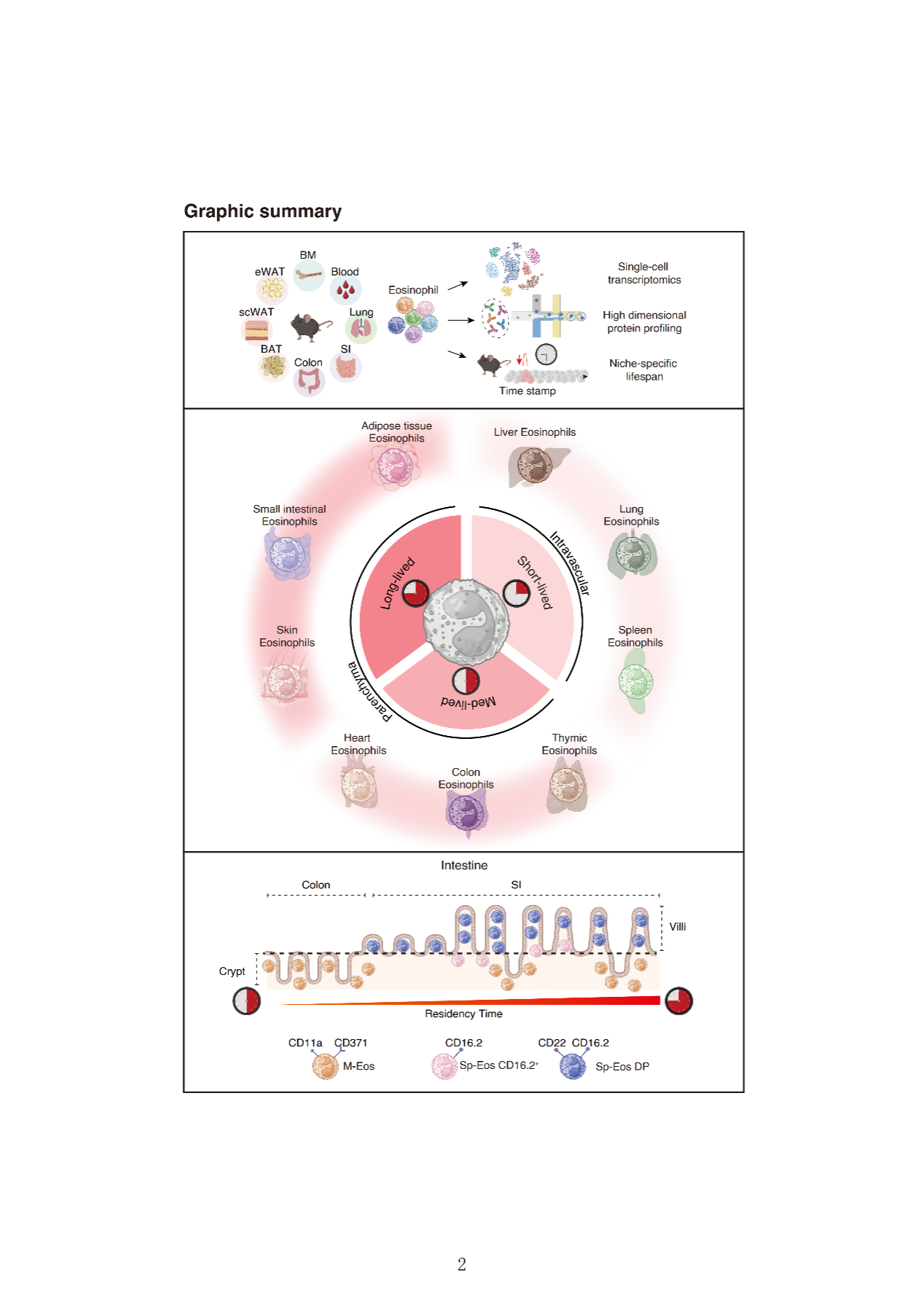
研究团队通过整合单细胞RNA测序、高维度表面蛋白组学和诱导性谱系示踪技术,系统描绘了嗜酸性粒细胞从骨髓前体、外周循环到组织定植的完整发育动态图谱。研究发现,组织驻留时间的延长促使嗜酸性粒细胞经历渐进式的功能特化,其异质性程度与细胞寿命呈显著正相关。短期驻留的嗜酸性粒细胞(短寿)维持相对均一的转录特征,而长期驻留的细胞(长寿)则表现出明显的层级化分子和表型特征。
为了系统阐明驻留时间依赖的细胞特化规律,本研究构建首个多组织嗜酸性粒细胞单细胞转录组-蛋白组联合图谱,整合分析了骨髓、血液及肺、小肠、结肠、皮肤和脂肪组织等多个器官的嗜酸性粒细胞,发现这些细胞呈现出显著的组织特异性分子印记和表面蛋白特征。首次实现了不同组织来源嗜酸性粒细胞亚群的前瞻性分选。此外,研究团队建立了一套经过严格验证的生物标志物组合,鉴定了一系列与分化轨迹相关的标记物——包括CD371、CD11a、CD22和CD16.2——这些标记物能够有效区分嗜酸性粒细胞不同发育阶段的细胞亚群—前体、循环型和特化的组织驻留型。将嗜酸性粒细胞研究从长期缺乏有效工具的领域,推进至具备单细胞分辨率的研究体系。
同时,该研究首次系统阐明了嗜酸性粒细胞在不同组织中的动态驻留特征与显著差异,具体表现在:肺嗜酸性粒细胞寿命短,主要位于血管内,且转录上均一;结肠嗜酸性粒细胞寿命中等,呈现有限的特化;小肠嗜酸性粒细胞长寿,主要位于肠实质层内,并分化为多个转录和表型上截然不同的亚群。通过谱系示踪技术,研究者建立了嗜酸性粒细胞的寿命与特化状态的联系,证实组织微环境的持续作用时间是驱动嗜酸性粒细胞多样化的关键决定因素。
进一步研究发现,驻留时长驱动的特化过程受到空间组织的精细化调控。在小肠内,长寿嗜酸性粒细胞优先定位于肠绒毛,而短期驻留的细胞则局限于隐窝。沿着肠道轴向,肠绒毛的消失与结肠中嗜酸性粒细胞寿命的缩短及异质性的降低相一致。这些结果表明,嗜酸性粒细胞的命运决定受到"微解剖定位-驻留时长"协同调控机制的精确控制。该发现首次在嗜酸性粒细胞中证实了空间微环境对细胞功能特化的调控作用,将基于微环境的免疫调控理论成功拓展至嗜酸性粒细胞研究领域。
综上,本研究首次将组织驻留时长确立为嗜酸性粒细胞功能分化的核心调控维度,这一发现与当前巨噬细胞和中性粒细胞研究中的前沿概念形成重要呼应。通过系统性构建首个跨组织单细胞多组学整合图谱(涵盖转录组和蛋白组),揭示了驻留时长是驱动嗜酸性粒细胞特化的主导因素。这一突破性成果为深入解析嗜酸性粒细胞在多重生理病理过程中的作用机制——包括但不限于粘膜屏障免疫、系统代谢调控、炎症反应和组织修复——提供了不可或缺的基础研究工具。为确保该基础研究成果的资源共享和广泛应用,本研究特别配套开发了交互式公共数据平台。
上海市免疫学研究所Svetoslav Chakarov课题组博士研究生胡雅楠为文章的第一作者,上海市免疫学研究所Svetoslav Chakarov研究员与中国医学科学院苏州系统医学研究所李子逸研究员为该论文的共同通讯作者。该研究得到了上海市免疫学研究所流式、成像平台和上海交通大学医学院基础医学院公共技术平台和实验动物中心,苏州系统医学研究所高性能计算平台的技术支持,以及科技部重点研发计划、国家自然科学基金等项目资助。
