2025年11月4日,上海交通大学医学院松江研究院仇子龙团队和南方科技大学生命科学学院王泽峰团队合作,在国际生物学知名学术期刊Nature communications杂志发表研究长文“Effective in vivo RNA base editing via engineered cytidine deaminase APOBECs fused with PUF proteins”,报道自主知识产权的高精度RNA碱基编辑器,为多类遗传疾病提供全新治疗策略。
新型RNA编辑器CU-REWIRE5不依赖CRISPR靶向机制,通过可编程ePUF10蛋白靶向目标RNA,已在RNA水平有效治疗多种现有碱基编辑器难以靶向的遗传疾病,是对现有RNA碱基编辑技术的有效替代,具有完全自主专利产权,前期工作发表在Nucleic Acids Research (2022)杂志。
本研究通过AI赋能的蛋白质重构策略,进一步设计了一类具有更高效率和精度的胞苷脱氨酶ProAPOBEC,与天然APOBECs相比,ProAPOBECs 的晶体结构更为规整与简洁,能够作为天然APOBEC蛋白的重要替代与补充。以ProAPOBECs 为核心构建的可编程RNA单碱基编辑系统CU-REWIRE5s,在多种序列背景(如GC、CC、AC和UC)下均展现出高效C-to-U 碱基编辑能力。该系统不仅在编辑效率和精度上优于天然APOBEC蛋白,还具有更优的序列识别特异性,能够从源头降低脱氨酶依赖的脱靶效应,并有效避免 bystander 编辑的产生。
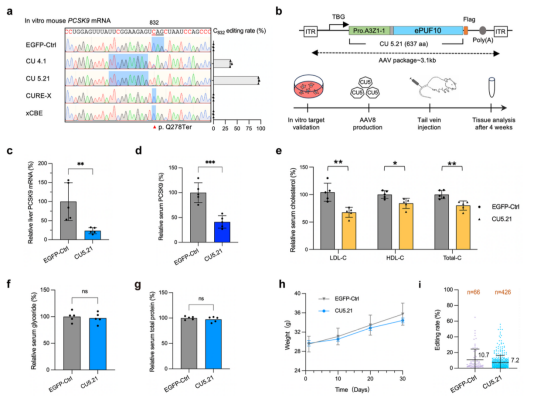
图1. CU5.21碱基编辑器有效降低 PCSK9表达并有效降低小鼠胆固醇水平。
在体内应用方面,研究团队利用 AAV 载体将 CU5.21 递送至小鼠肝脏,实现了对 Pcsk9 mRNA 的有效编辑,从而显著降低了血清胆固醇水平(图1)。同时,将 CU5.15 递送至自闭症小鼠模型大脑,不仅成功纠正了 Mef2c mRNA 的致病突变,还明显改善了相关行为学表型(图2)。
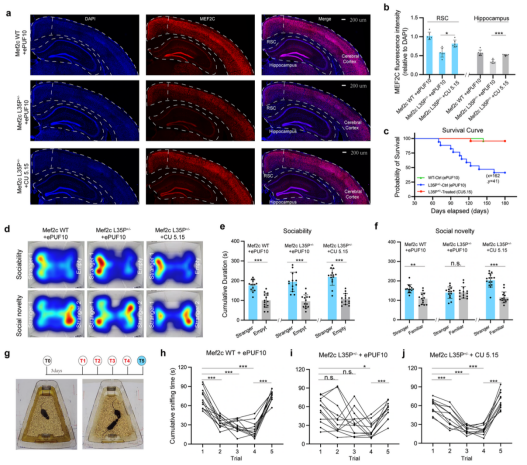
图2. CU-REWIRE5.15碱基编辑器有效恢复Mef2c孤独症小鼠的异常社交行为。
总体而言,该研究在技术与应用两方面均取得重要突破:一方面,成功开发出编辑效率与精度更高的新型胞苷脱氨酶 ProAPOBECs;另一方面,展示了其在遗传性疾病治疗中的巨大潜力。通过精准的RNA编辑来纠正致病突变,有望为目前临床需求迫切、尚无有效治疗手段的多类遗传病提供全新的治疗策略。
该论文的共同第一作者为上海交通大学医学院松江研究院韩文建副研究员和复旦大学医学遗传研究院袁博青年研究员;共同通讯作者为韩文建副研究员、王泽峰教授和仇子龙教授。该研究工作得到了“脑科学与类脑研究”国家重大科技专项、国家自然科学基金委重点项目、青年科学基金项目、上海市卫健委种子计划项目以及上海市超级博士后激励计划等项目资助。
文章链接:https://www.nature.com/articles/s41467-025-64748-6
