2025年,上海交通大学公共卫生学院栾洋研究员团队在马兜铃酸(Aristolochic Acid, AA)的研究中取得进展,相继在《Mutagenesis》、《Food and Chemical Toxicology》、《Phytomedicine》和《Biomolecules》领域权威期刊上发表研究论文,揭示了马兜铃酸的毒性机制与潜在药用价值。该团队长期致力于解码这一传统中药有效成分的双面性,旨在保留祖先智慧的同时,探索其安全应用路径。
马兜铃酸是存在于马兜铃科植物中的天然化合物,该科植物作为中药应用具有悠久的历史。上世纪六十年代,马兜铃酸在德国以商品名Tardolyt ®上市,功效包括免疫调节剂、抗炎和抗肿瘤。这些药物一直到应用上世纪末,才因为发现其可能具有某些致癌性和肾毒性,被限制使用。作为祖先留下的瑰宝,研究团队的目标并非简单贴上“有毒”标签,而是深入探索其毒性机制,以期找到无毒或低毒的结构,重新阐明其药理活性,让传统中药在现代医学中焕发新生。

(图片来自津巴多教授《路西法效应》封面图)
马兜铃酸的“双面刃”,本就是事物的两面性。只有阐明了它的毒性机制,才有可能避免其毒性使其回归药物。栾洋研究员团队经过多年马兜铃酸毒性机理的研究,筛选出完全无毒性的马兜铃酸类似物并阐明了无毒机制,之后又探索了活性发现具有抗炎作用。该团队今年发表的论文继续深入进行了毒性机制研究与活性探索。
研究亮点
1. AAI与肝癌风险的关联机制
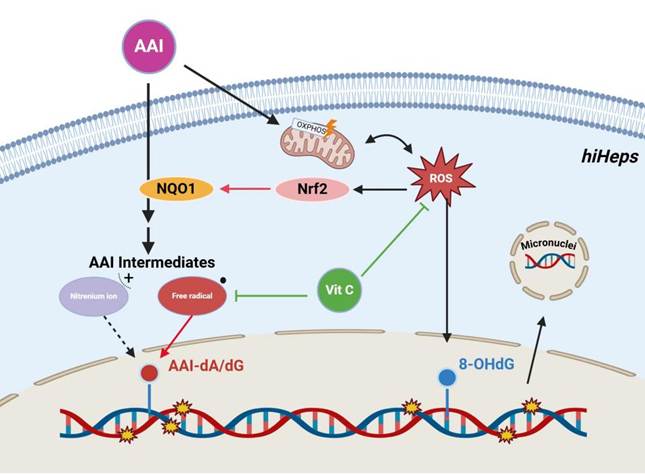
长期以来,AAI与人类肝癌的因果关系存在争议。为更准确评估其对人肝细胞的遗传毒性风险,本研究采用功能成熟的人源诱导肝样细胞(hiHep细胞)作为体外模型,该细胞在基因表达和代谢功能上高度模拟原代人肝细胞。研究证实,AAI在hiHep细胞中可引起高水平的DNA加合物(dA-ALI 和 dG-ALI)并显著提升微核频率,说明其具有强遗传毒性并可导致染色体畸变。机制方面,AAI还诱导线粒体功能障碍和活性氧(ROS)积聚,引起氧化性DNA损伤标志物8-OHdG水平上升。进一步通过抗坏血酸(Asc)干预实验发现,该抗氧化剂能有效抑制AAI诱导的ROS生成、DNA加合物形成及微核产生,提示AAI代谢过程中可能涉及自由基中间体,并在上述细胞模型中验证了氧化应激为其核心致病机制。该研究不仅深化了对AAI肝毒性机制的理解,也为含马兜铃酸中草药的肝毒性评估和肝癌风险防控提供了重要的科学依据。研究发表在毒理学领域权威期刊Mutagenesis(2025 Oct 17;40(4):542-549. doi: 10.1093/mutage/geaf012.)上。
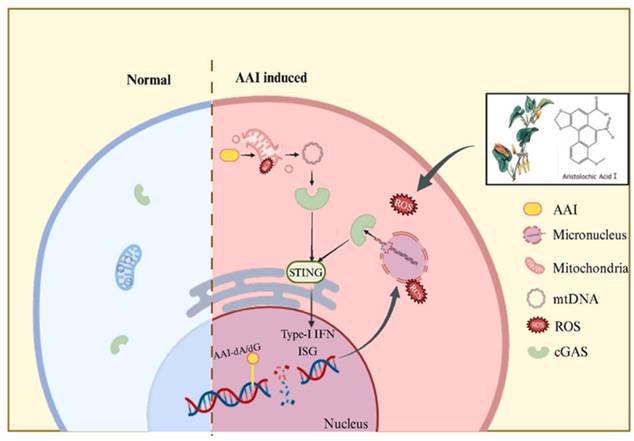
2. AAI诱导肾损伤的全新机制—cGAS-STING炎症通路
这项研究系统揭示了AAI诱导肾损伤的全新机制,即通过线粒体DNA泄漏与微核DNA暴露双重途径协同激活cGAS–STING天然免疫信号通路,进而驱动肾脏炎症反应。该研究利用了人源细胞(HK-2,hiHeps)和STING基因缺陷小鼠体系,通过深入的研究发现,AAI不仅诱导线粒体膜电位下降、活性氧(ROS)水平升高和线粒体通透性转换孔(mPTP)开放,导致mtDNA释放至胞质,还能够在代谢活化后引起染色体损伤与微核形成,AAI引发的氧化应激可破坏微核膜的完整性,使其包裹的DNA暴露于细胞质中,进而被cGAS识别并激活下游STING–NF-κB通路,促进炎症因子表达。该研究将AAI的遗传毒性与炎症反应通过cGAS–STING通路关联起来,不仅深化了对AAI肾毒性机制的理解,也为其他能够引起DNA损伤与微核形成的遗传毒性物质的毒性研究提供了新的视角。研究发表在毒理学领域权威期刊Food Chem Toxicol(2025 Jul 16;204:115648. doi: 10.1016/j.fct.2025.115648)上。
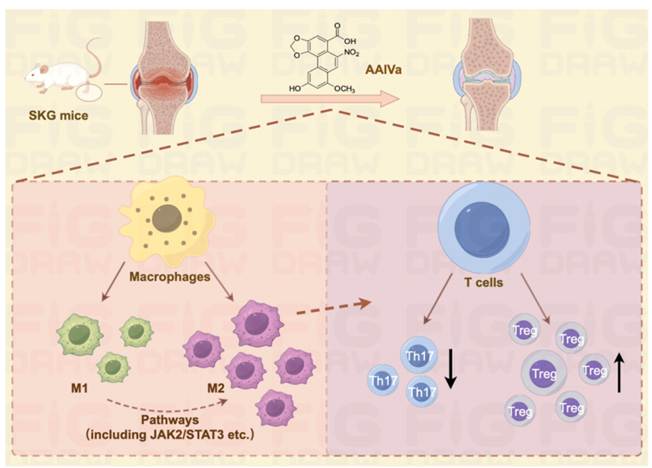
3. 无毒AAIVa抗关节炎潜力
团队此前发现无毒性马兜铃酸类似物AAIVa具有抗炎作用。类风湿性关节炎作为一种自身免疫性疾病,其治疗仍面临药物副作用大、部分患者疗效不佳等挑战。该研究利用自发性关节炎SKG小鼠模型,发现AAIVa对类风湿性关节炎具有显著治疗效果。机制研究发现,AAIVa通过两大免疫调节机制发挥作用:一是诱导巨噬细胞向抗炎型M2极化,二是它能够调节辅助性T细胞17(Th17)与调节性T细胞(Treg)之间的平衡,纠正免疫稳态失调。在这些机制共同作用下,AAIVa有效减轻了关节局部的炎症程度,并改善了骨微结构的破坏情况,为后续信号通路解析和化学结构修饰提供了实验依据。AAIVa作为一种结构新颖的无毒衍生物,不仅展现了明确的疾病缓解能力,其免疫调节机制也为开发新型抗关节炎药物提供了有价值的科学依据和颇具前景的候选化合物,为后续深入探索其结构优化奠定了良好基础。研究发表在中药领域权威期刊Phytomedicine(2025 Apr;139:156557. doi: 10.1016/j.phymed. 2025.156557)上。
4. 马兜铃酸类似物的De Novo合成与毒性评估
为深入探究马兜铃酸类化合物的构效关系,团队与沈阳药科大学合作,通过De Novo策略,成功制备了一系列结构精确的马兜铃酸类似物。利用该系列化合物,系统评估了不同取代基对肾毒性的影响。结果表明,硝基官能团的缺失能在一定程度上改变其毒性特征,但并未完全消除细胞毒性,这提示了可能存在经典DNA加合物机制的之外的潜在毒性路径,例如氧化应激或线粒体功能障碍等。此项工作为进一步解析马兜铃酸结构与毒性/活性构效关系提供了物质基础,也为后续结构改造进行药物研发奠定了重要基础。研究发表在Biomolecules(2025 Jul 14;15(7):1014. doi: 10.3390/biom15071014.)上。
综上,团队持续在进行马兜铃酸研究,目前的研究包括鉴别高危人群,以明确什么样的人不能用这些中药。此外还在探索药物活性和作用靶点,继续通过结构改造希望把它开发成为新型药物,让祖先的智慧在现代医学中焕发新生。
上述Mutagenesis、Food Chem Toxicol和Phytomedicine杂志论文的第一作者依次为公共卫生学院的雷雨阳、胡雨石和郜沁文同学,栾洋研究员为通讯作者。Biomolecules杂志论文的第一作者为沈阳药科大学的高建飞,通讯作者为沈阳药科大学的胡春教授和上海交通大学公共卫生学院栾洋研究员。