12月6日,国际肿瘤免疫治疗学会官方杂志《Journal for ImmunoTherapy of Cancer》在线发表了上海交通大学医学院公共卫生学院王慧/李晓光联合团队题为“Caspase-9 inhibition triggers Hsp90-based chemotherapy-mediated tumor intrinsic innate sensing and enhances antitumor immunity”的研究论文,该研究揭示了化疗药物诱导的含半胱氨酸的天冬氨酸蛋白水解酶(Caspase)信号是限制肿瘤先天免疫感知的主要内在障碍,而阻断Caspase 9信号可显著增强HSP90化疗药物诱导的Ⅰ型干扰素(IFN-I)产生和先天免疫应答,联合抗PD-L1免疫治疗可实现肿瘤完全消退,为肿瘤治疗提供了潜在的创新策略。
传统的癌症治疗方法,例如化疗、放疗和靶向治疗,通常通过直接杀伤肿瘤细胞的方式来抑制癌症的生长和扩散。这些治疗方法通常会触发Caspase信号,导致肿瘤细胞发生凋亡,并同时引发免疫系统的沉默反应。然而,目前仍不清楚激活的Caspase是否是化疗药物引起免疫沉默的主要原因,以及它们在化疗药物引发细胞死亡中是否是不可或缺的。为了解决这一问题,研究团队建立了一个IFN-I免疫应答的高通量体外筛选系统,并利用包含1214种化疗药物的抗癌药物库进行了验证实验,结果表明抑制Caspase信号能够广泛提高化疗药物引发的IFN先天免疫信号,并促进IFN-I的产生。在这项无偏倚筛选中,研究人员发现IFN-I应答排名前十的候选药物中有8种是Hsp90抑制剂(见图1),凸显了Hsp90作为调节先天免疫信号重要靶点的潜在优势和重要性。
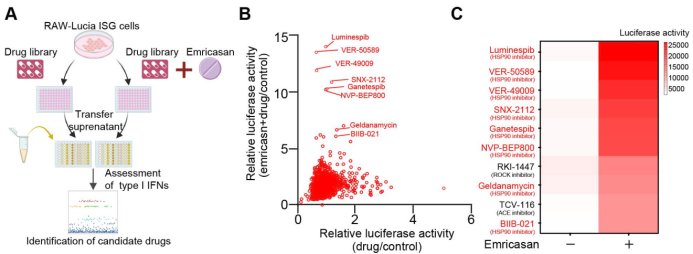
图1 阻断Caspase显著促进化疗药物诱导的Ⅰ型干扰素的产生
机制研究发现,Hsp90抑制剂能够激活内源性凋亡并导致线粒体DNA的释放,从而引发cGAS-STING-IRF3依赖的DNA感应信号激活。然而,内源性凋亡会触发Caspase3/7/9信号并介导cGAS/STING/TBK1的剪切,阻碍了由线粒体DNA介导的先天免疫感知。在泛Caspase抑制剂存在或Caspase 9(内源性凋亡关键中介因子)敲除状态下,Hsp90抑制剂显著激活了Ⅰ型干扰素信号;敲除Caspase 8(外源性凋亡的关键执行因子)并未发现这一现象。有趣的是,体内外实验证实抑制内源性Caspase通路并没有影响Hsp90抑制剂引起的细胞死亡,表明激活内源性Caspase通路可能不是以HSP90为靶点的化疗引起的细胞死亡及随后凋亡细胞清除的必要因素。
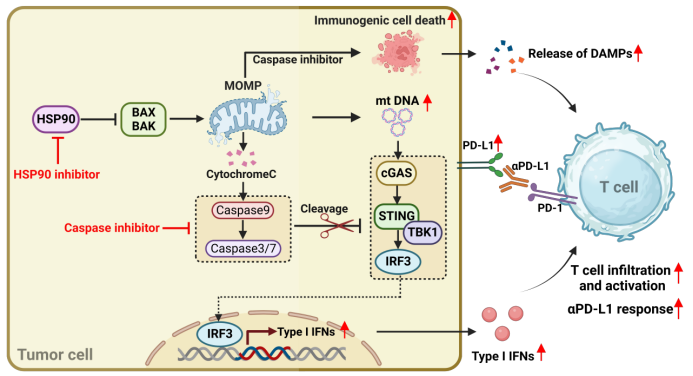
图2 阻断Caspase增强Hsp90抑制剂抗肿瘤策略示意图
在小鼠肿瘤模型中,阻断Caspase信号显著增强了肿瘤的免疫原性并激活了先天免疫反应,导致显著的抗肿瘤效果。这种免疫激活的能力明显增强了肿瘤对免疫检查点抑制剂αPD-L1的药物敏感性,并实现了肿瘤的完全消退(见图2)。这项研究提出了通过靶向抑制Caspase来增强现有抗癌药物治疗的策略。它挑战了传统通过激活Caspase诱导肿瘤细胞凋亡的治疗方法,为提升化疗的免疫原性提供了新的思路和方法。
上海交通大学医学院公共卫生学院博士李锦阳、韩筱俣和博士后孙马钰为该论文共同第一作者。公共卫生学院王慧教授和李晓光研究员为该论文的共同通讯作者。该研究得到了国家重点研发计划和国家自然科学基金等项目的资助。
原文链接:https://jitc.bmj.com/content/11/12/e007625