脉络膜黑色素瘤(Uveal Melanoma,UM)是成人最常见的眼内恶性肿瘤,恶性程度高,致盲率、致死率高。约有50%的UM患者最终会发生转移,转移后平均生存时间仅半年。UM发病是多基因病,由多种致病因素共同参与,如GNAQ/GNA11突变、MAPK信号通路激活、miRNA异常表达等。经典遗传学认为,基因的表达和调控元件在染色体呈线性排列,然而在实际生命过程中,染色体并不以线性结构存在,而以复杂的三维空间结构存在于细胞核中。在基因组距离很远的基因可以由染色体的折叠或包装形成复杂区域,能从三维空间上对基因的表达进行调控。然而,脉络膜黑色素瘤细胞中是否存在肿瘤特异性染色体三维构象?这些构象又是通过何种机制促进肿瘤发生发展的?这些问题尚不清楚。
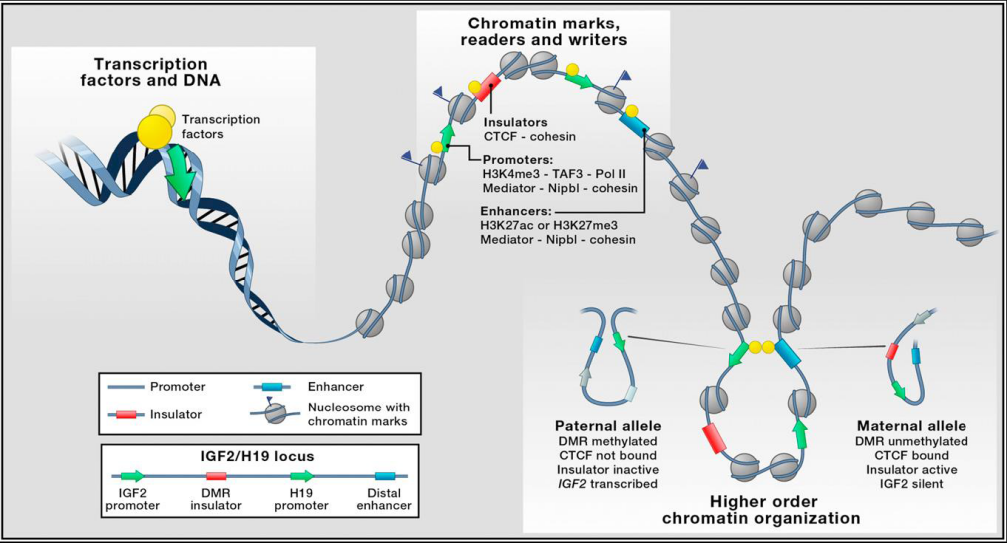
图一:染色体构象调控基因表达模式图
为了解答上述疑问,柴佩韦博士应用转录组高通量测序技术(RNA-seq)联合高通量染色体构象分析(CTCF ChIP-seq、Hi-C)等技术手段,发现脉络膜黑色素瘤标本中神经降压素(NTS)显著高表达并伴有启动子区染色体构象异常。首先,细胞实验发现神经降压素促进脉络膜黑色素瘤细胞增殖、迁移。在眼内原位荷瘤小鼠模型也得到的结果,更重要的是,在脉络膜黑色素瘤临床患者队列中发现,NTS在临床组织中高表达,并预示着患者的不良预后。既然NTS促进脉络膜黑色素瘤发生和发展,那么它的机制是怎样的呢?柴佩韦博士进一步研究NTS异常转录的上游机制。利用染色体构象捕获(3C)技术,发现该启动子区域与上游800kb增强子形成癌性染色体环,劫持该序列并形成癌增强子(Onco-enhancer),促进NTS基因表达。研究发现,该染色体构象为肿瘤特有,而正常组织细胞中无此构象。利用CRISPR-Cas9基因编辑技术靶向删除特异结合的增强子区,染色体异常构象消失,NTS基因被沉默,脉络膜黑色素瘤增殖和迁移被显著抑制。
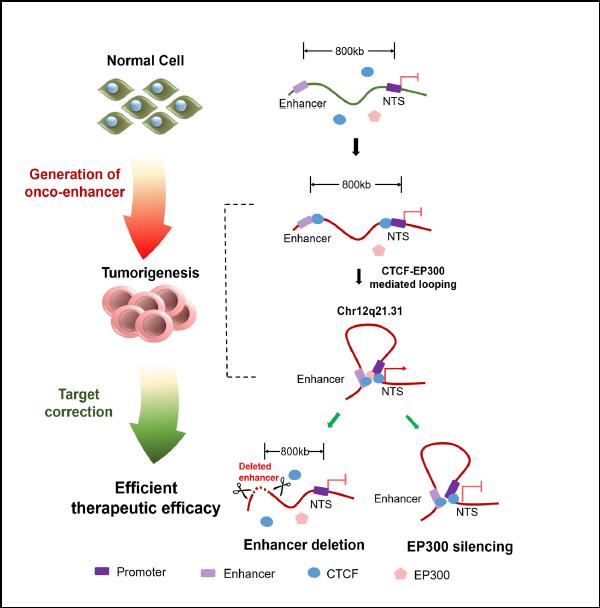
图二:染色质三维构象异常诱导癌增强子形成
该研究结果对染色体异常构象在肿瘤发生中的功能及转录调控机理有了全新的认识,为脉络膜黑色素瘤诊断和治疗提供潜在的新靶点。该研究近日发表于学术权威杂志《NucleicAcidsRes》.
范先群教授团队长期致力于眼恶性肿瘤的临床与基础研究。聚焦于脉络膜黑色素瘤的临床治疗和基础研究。建立了眼肿瘤生物样本库,揭示OCT4等干性基因表达的染色体构象调控新机制(Cell Stem Cell 2013),发现视网膜母细胞瘤中12号染色体上异常开放的新致病区GAU1(Nucleic Acids Res 2018);首次发现脉络膜黑色素瘤中m6A甲基化通过促进抑癌基因HINT2基因翻译抑制肿瘤发生的m6A RNA甲基化调控新机制(Mol Cancer 2019),鉴定了新的lncRNA-ZNNT1,通过调控细胞自噬抑制肿瘤发生,揭示自噬调控新机制(Autophagy 2019);首次发现染色体构象变异导致的lncRNA ROR异常高表达,可“诱骗”组蛋白H3K9的甲基化酶G9A离开修饰位点失去活性,导致癌基因TESC高表达,促进肿瘤生长和转移,提出“陷阱修饰”学说(Genome Biol 2015,Molecular Therapy 2019),F1000评价“揭示肿瘤发生新机制,是肿瘤研究的范例”。发现并命名视网膜母细胞瘤治疗新靶点RBAT1,创建多靶点治疗新方法(Mol Cancer 2020)。首次利用纳米碳点的荧光增强作用,实现肿瘤细胞可视化监测,建立眼恶性肿瘤早期预警和临床诊断新模式(Adv Mater 2020)。临床治疗方面,九院眼科也通过综合运用巩膜敷贴治疗、玻璃体切除等方法治疗脉络膜黑色素瘤,力图实现保生命、保眼球、保视力。