样本来源
可分析各种来源的样本,对于样本的来源没有特殊的要求。如模式动物、组织、培养的细胞、体液样本、植物、微生物等,均可做蛋白质组学的分析。
样本准备
将新鲜采集的样本,直接冷冻于-80℃冰箱中保存。
待样本收集齐全后,将样本与干冰一起寄送。注意在整个冻存和寄送期间,避免样本反复冻融,防止蛋白质降解。
差异定量
基于蛋白质组的相对定量研究与转录组芯片、RNA-Seq在目的上基本类似,就是寻找2种或者更多种不同状态、时间、品种的样品在蛋白表达水平上的差异。从而与其在表型上的差别进行关联和深入研究。这是目前蛋白质组学技术与生物学、临床结合最紧密也是应用最多的技术路线。
研究流程
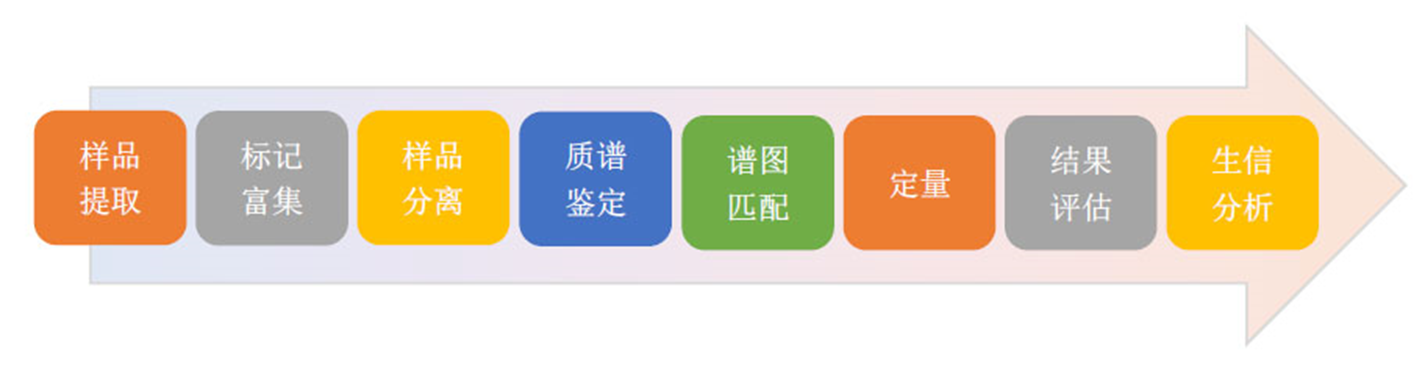
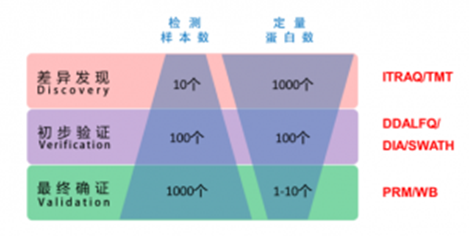
方案选择简易推荐
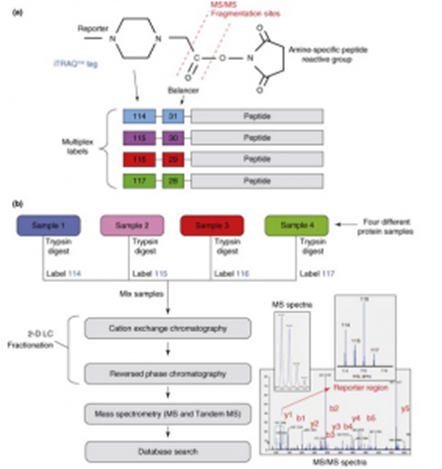
标记定量ITRAQ/TMT
对于需要用标记定量的蛋白质样品,在提取出高质量的蛋白质后,需要对样品进行同位素标记。可根据样品的数量选择标记的试剂(iTRAQ:2-8个样品,TMT:2-10个样品)。
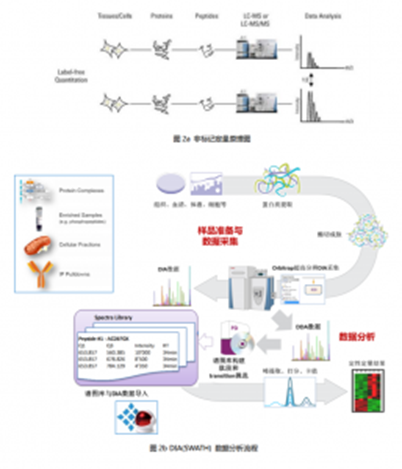
非标记定量
对于非标记定量的蛋白质组学(Label-free Quantitation)分析。分为DDA/DIA(SWATH)LFQ两大类方法。非标记定量方法不需要标记试剂,对体系的干扰最小,成本相对较低,对样本的数量也没有限制,可同时定量2~无限种状态的样本。其差异分析主要依赖于软件的平行比对和计算。因此对软件的要求较高。在样品较少的情况下,我们推荐DDA-LFQ方法,大量样品需要定量筛选的情况下,推荐DIA(SWATH)-LFQ方法,后者实验流程、数据分析较为复杂,但可以平行检测几十上百种生物学样品。
实验原理介绍(点击展开大图)
标记定量
非标记定量
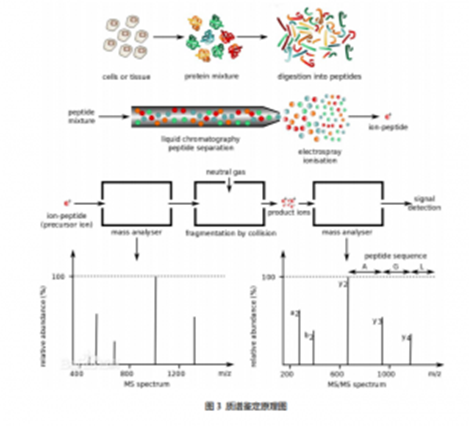
质谱鉴定原理