G蛋白偶联受体的七跨膜α-螺旋结构,图片来自Valeryns/Wikipedia。
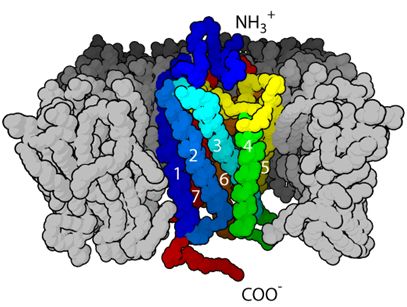
在一项新的研究中,来自美国密歇根大学、斯坦福大学和ConfometRx公司的研究人员首次捕获到一种关键的细胞受体在发挥作用时的冷冻电子显微图片。
这些发现揭示出关于G蛋白偶联受体(G protein-coupled receptor, GPCR)工作机制的新信息。GPCR是与人体内几乎每种功能都相关的分子信息传递的中间体。
GPCR停留在细胞膜上,检测来自细胞外部的信号,并且将这些信号传递到细胞内部来发挥作用。它们对光线、味觉和嗅觉等感官输入、激素和神经递质等信号作出反应。
这些新的近原子分辨率图片对这些重要的受体如何结合和传递来自肽类激素的信号提供非常详细的观察。
这些研究人员揭示出激素胰高血糖素样肽-1(Glucagon-like peptide-1,GLP-1)如何在细胞的外面上结合它的受体,以及这如何导致这种受体延伸到细胞中的部分发生构象变化,而这种构象发生变化的受体随后结合和激活细胞中的G蛋白。
GLP-1在调节胰岛素分泌、碳水化合物代谢和食欲中发挥着重要作用。它结合B类G蛋白偶联受体(B-GPCR)上,不过关于GLP-1和B-GPCR发生准确的相互作用的信息一直受限于不能够捕获到这种复合体发生作用时的结构图片。
论文共同通信作者、密歇根大学医学院生命科学研究所研究员Georgios Skiniotis说,“很难过度夸大GPCR的重要性。几乎一半的药物都靶向GPCR,利用冷冻电子显微技术(cryo-electron microscopy, cryo-EM)获得它们的结构图片将在进一步的药物发现工作中发挥着至关重要的作用。这种GLP-1受体是2型糖尿病和肥胖症的一种重要的药物靶标。”
GPCR复合体的大小和易碎性使得人们很难利用长期使用的金标准成像方法(X射线衍射晶体分析法)捕捉到它们的结构图片。它让斯坦福大学医学院分子与细胞生理学教授Brian Kobilka(另一名论文共同通信作者)花了很多年的时间才获得首张GPCR复合体的结构图片。
当前的这项研究是利用cryo-EM开展的。论文共同第一作者、Skiniotis实验室博士后研究员Yan Zhang说,“利用cryo-EM,我们也能够发现关于GPCR如何弯曲和运动的更多信息。我们能够观察到很难形成结晶的GPCR复合体的功能性变化。”(新闻来源:生物谷 Bioon.com)
Cryo-EM structure of the activated GLP-1 receptor in complex with a G protein.
https://www.nature.com/nature/journal/vaop/ncurrent/full/nature22394.html
