MicroRNA简介
MicroRNA (miRNA)是一类内生的、长度约为20-24个核苷酸的小RNA,其在细胞内具有多种重要的调节作用(图1)。每个miRNA可以有多个靶基因,而几个miRNA也可以调节同一个基因。这种复杂的调节网络既可以通过一个miRNA来调控多个基因的表达,也可以通过几个miRNA的组合来精细调控某个基因的表达。据推测,miRNA调节着人类三分之一的基因。最近的研究表明大约70%的哺乳动物miRNA是位于TUs区(transcriptionunits,TUs),且其中大部分是位于内含子区。一些内含子miRNA的位置在不同的物种中是高度保守的。miRNA不仅在基因位置上保守,序列上也呈现出高度的同源性。miRNA高度的保守性与其功能的重要性有着密切的关系。
MicroRNA的产生过程
MicroRNA的合成始于RNA聚合酶Ⅱ的转录过程,通常其编码基因位于内含子区域并有自己的启动子区。伴随着长转录本的产生,Drosha,一种类型ⅢRNase,同辅因子蛋白DGCR8形成复合体后结合于pri-miRNA上(图2)。Drosha上的两个RNase结构域对pri-miRNA 3’及5’末端进行切割,产生发夹状的pre-miRNA。随后,在exportin 5-RNA•GTP复合体介导下,pre-miRNA完成核质转移过程。在细胞质中,一种称为Dicer的核酸酶与TRBP共同结合在pre-miRNA上并切割掉末端的环状区域形成双链RNA片段,后者随即被组合至RISC复合体中。AGO蛋白会对两条链进行选择,并选择其中一条形成有活性的RISC复合体,发挥其多样性的调控功能。
在人体中,miRNA的生成受到严格的信号通路调控,其中涉及到四类至关重要的酶分子,分别是Drosha、exportin 5、Dicer及AGO2,如图2所示。在很多类型的肿瘤中,包括神经母细胞瘤、卵巢癌、肾母细胞瘤等都发现了这几类酶发生了关键位点突变。
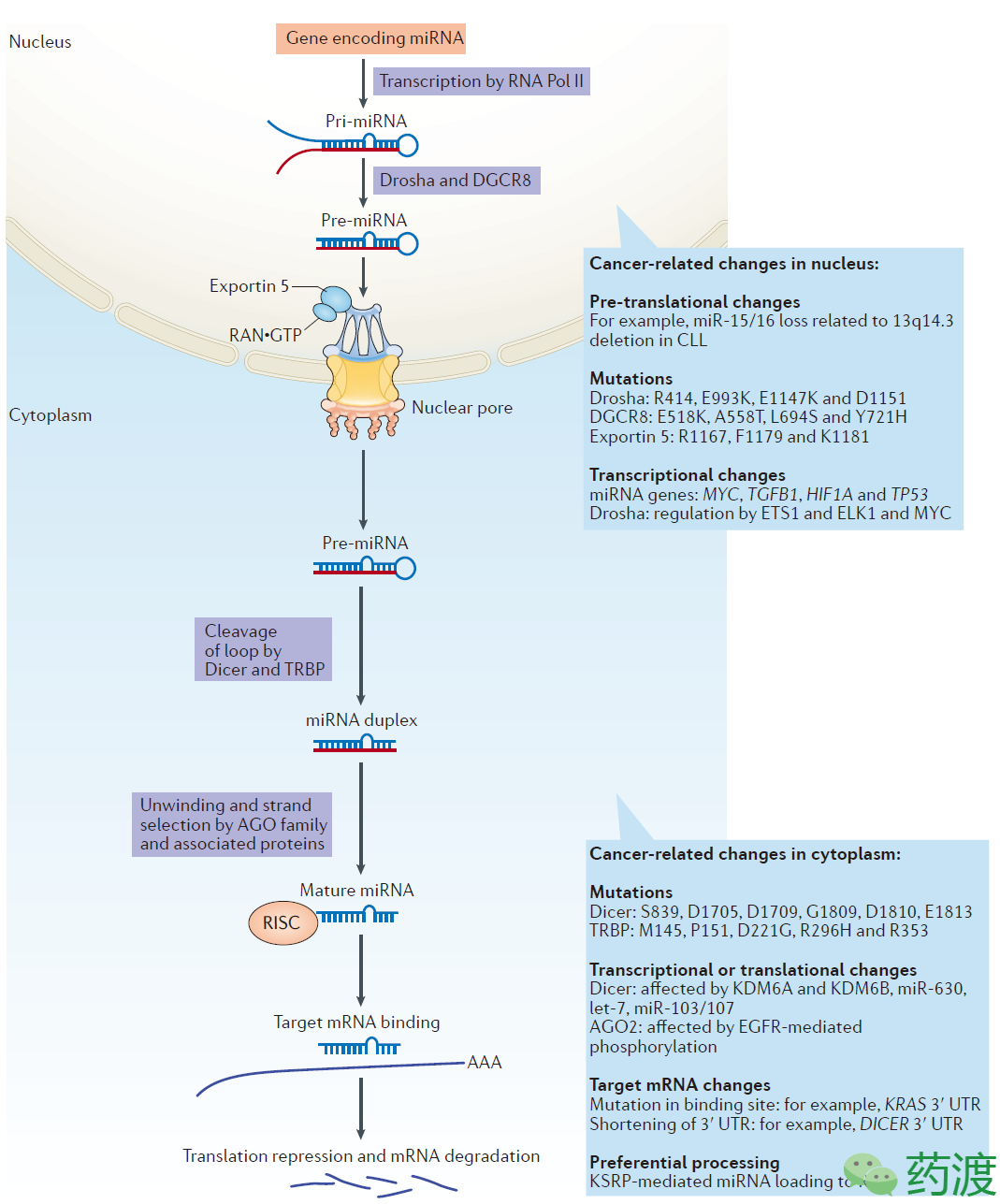
Fig2. Overview of microRNA (miRNA)biogenesis
MicroRNA在临床前研究中的应用
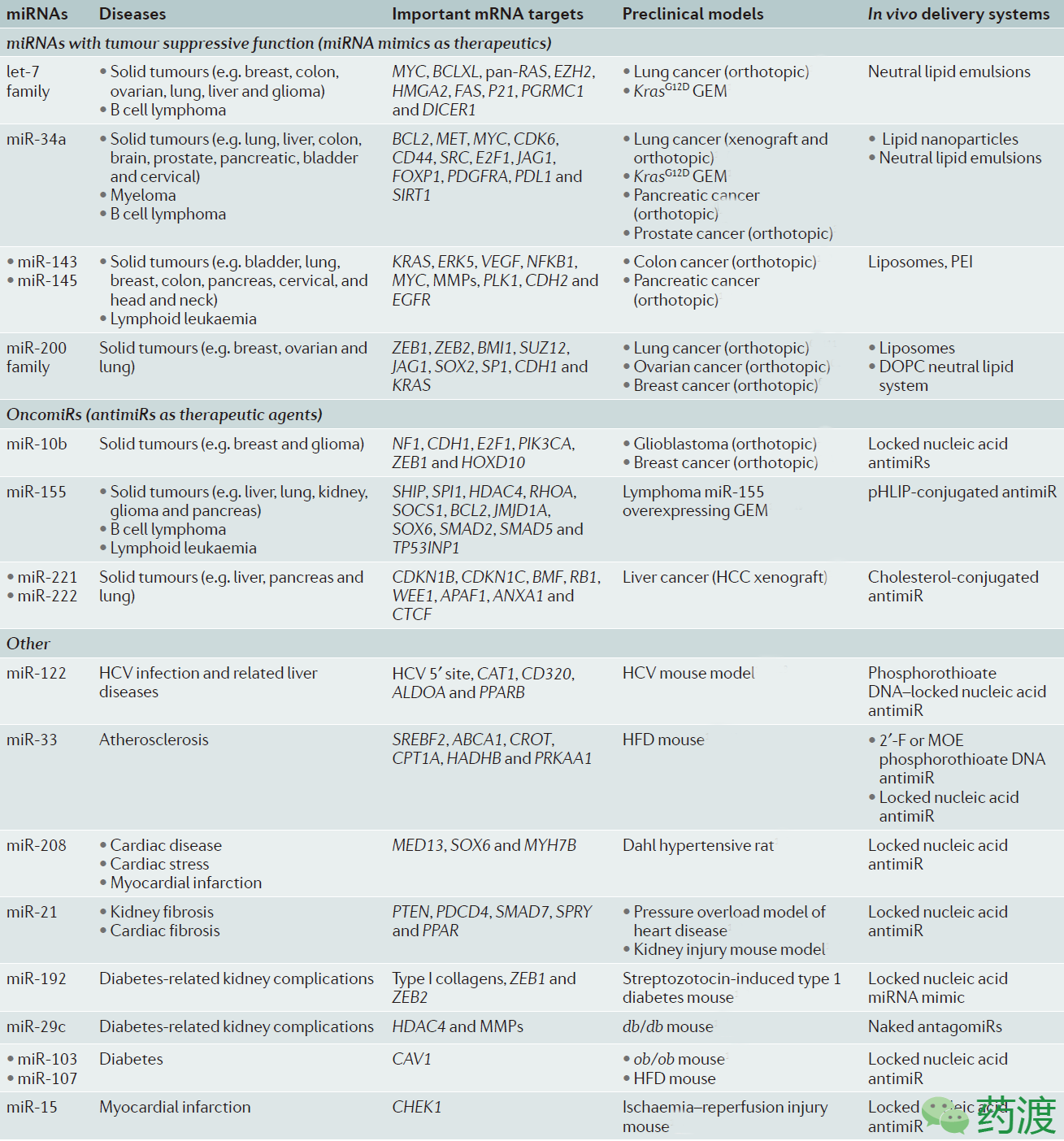
miRNA如此复杂而又精细的调节机制,使得整个信号通路在多种病理过程中成为很有希望的治疗药物(通常以miRNA类似物形式出现)或药物治疗的靶点(通常以antimiRs形式出现),如下表所示。与此同时,RNA分子输送技术的提高,也使得基于miRNA的疾病治疗方案变得更加现实。
表1. Selected miRNAs in cancer and other diseases and their therapeutic manipulation in preclinical models
MicroRNA相关药物研发流程
药物研发的基础在于对病理过程分子机制的深入理解。miRNA相关药物的研发也需要基于对患者样本进行深入系统的分析,并通过体内外模型阐明靶标miRNA与疾病间的生物学关系及发病机制。目前有很多的公共的数据库可供检索,能够查询到不同患者正常及病变组织中基因组学及蛋白质组学的相关数据。通过数据库分析与实验验证结合,可确定一些有希望的miRNA候选。接下来主要的挑战性工作包括对体内应用的miRNA类似物及antimiRS进行化学修饰以增加其稳定性,以及选择优化药物输送体系。
对于基于核苷酸的药物而言,其在体内发挥作用的最大障碍在于核酸酶的降解作用及内吞过程中药物分子从内吞体的逃逸。通过化学修饰,如增加2’甲氧基及LNAs等技术,可以提高药物分子的稳定性,延长其半衰期。除了通过化学修饰增加稳定性外,胶囊技术的拓展,也可以提高药物分子的输送效率。常用的输送系统包括脂质纳米粒,如中性脂肪乳剂或靶向部分连接的树状大分子复合物。对于药物输送系统,最大的挑战性在于潜在的免疫刺激作用及对病变区域靶向特异性的缺失。一旦这些困难能够解决,基于小RNA的治疗药物必须在啮齿类动物及非人灵长类动物模型中开展疾病特异性试验。此后还应该对毒理学数据及靶标响应性进行慎重的分析评估,以免临床试验在较早阶段即宣告失败。
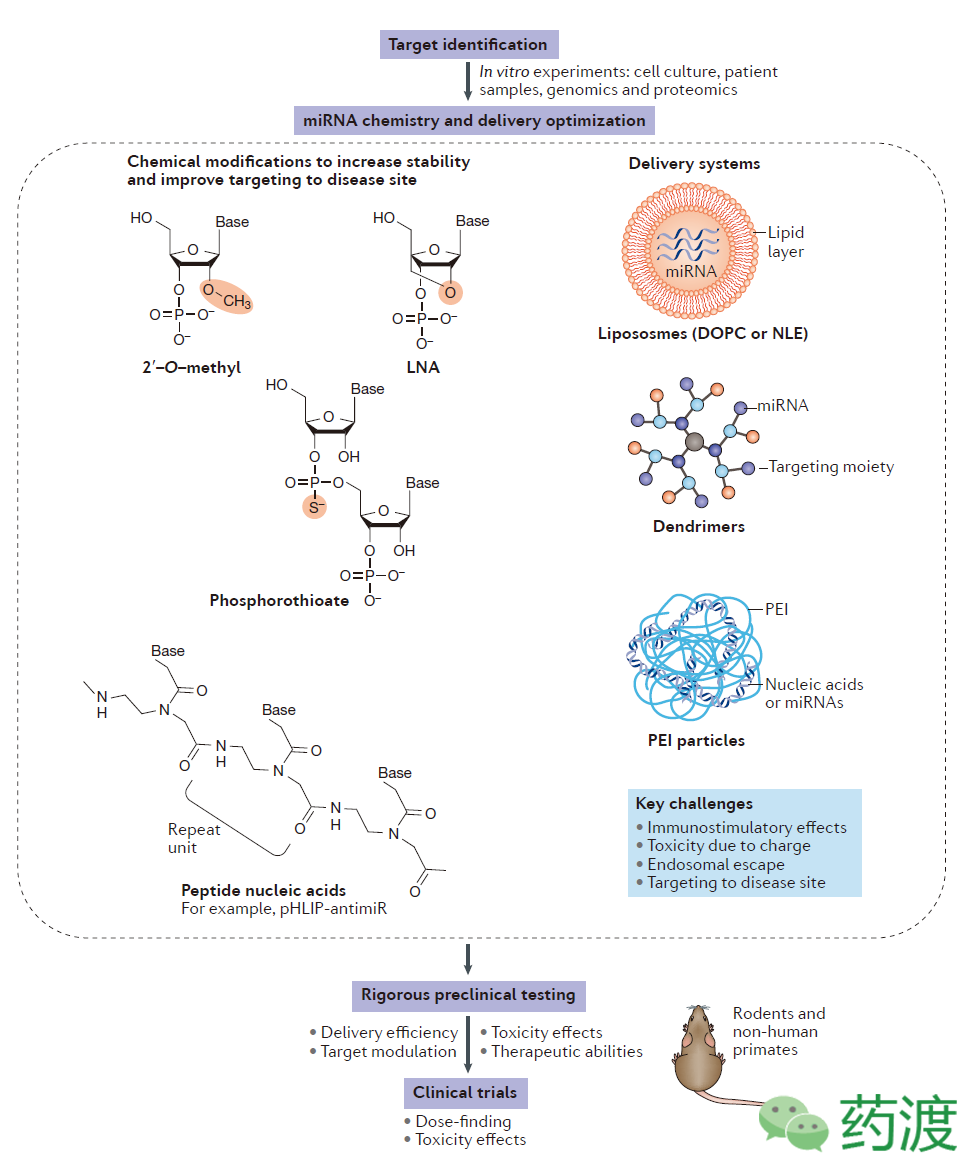
Fig3. Summary of the key steps in the development of miRNA therapeutics
miRNA相关药物临床研究进展
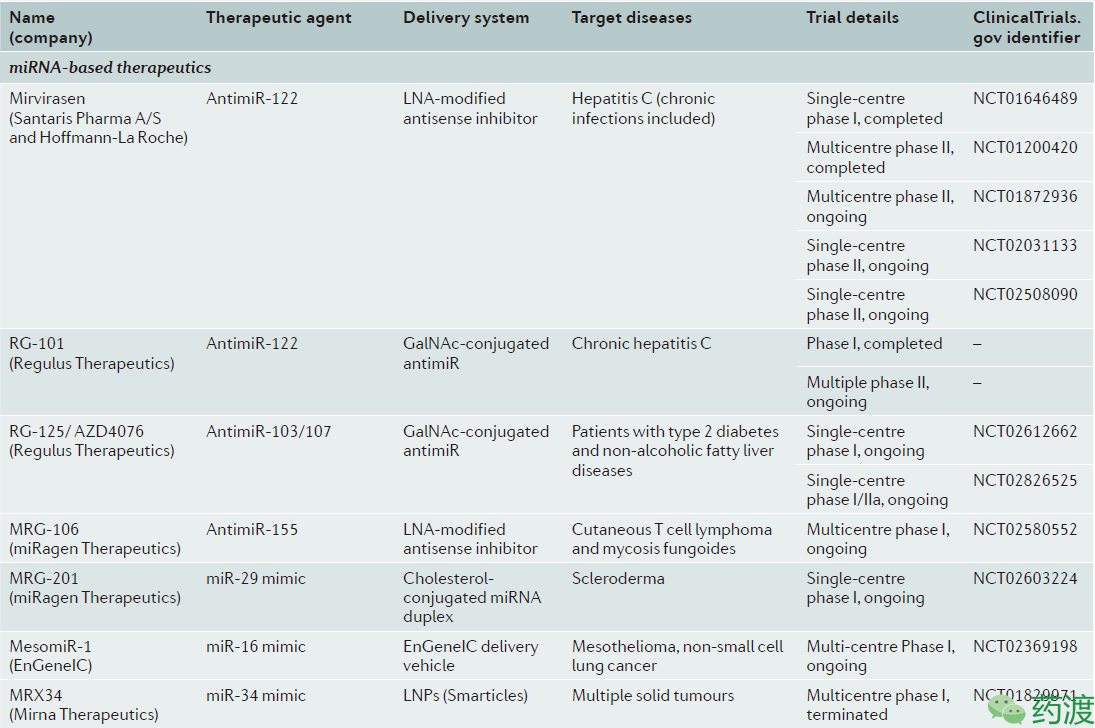
miRNA最早发现于1993年,此后该领域进展迅速,在各方向均取得了巨大成就。其主要的三位发现人,来自麻省大学医学院的Victor Ambros、麻省总医院的Gary Ruvkun以及英国哥伦比亚大学的David Baulcombe获得了2008年的拉斯克基础医学奖,并连续多年成为诺贝尔生理与医学奖的热门候选人。在短短20余年间,对miRNA的研究已从实验室进入到临床阶段,目前有很多成功的Ⅰ期临床试验以及正在开展的Ⅱ期临床试验,如表2。
表2. Selected list of miRNA therapeutics in clinical trials
Miravirsen:2014年8月4日,罗氏(Roche)宣布收购丹麦制药商Santaris,该公司总部位于丹麦哥本哈根,是一家私人持有的生物制药公司,该公司开创的专有锁核酸(locked Nucleic Acid,LNA)平台,使RNA靶向治疗跨入了一个崭新的时代。
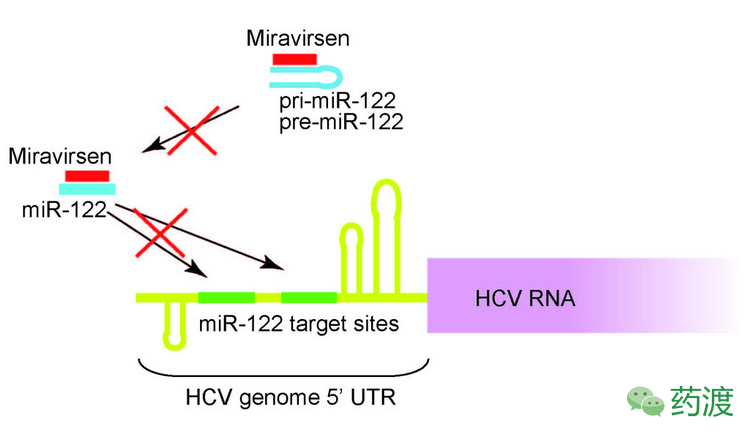
Miravirsen是最早进入到临床研究阶段的miRNA药物之一,采用锁核苷酸(LNA)技术的一段15nt长度反义RNA链,可同miR-122的5’端互补治疗HCV感染(图4)。后者对宿主的侵染过程严重依赖肝脏中丰度最高的miR-122。在啮齿类及非人灵长类动物模型中的临床前研究表明,Miravirsen展现出良好的肝脏输送效率、胆固醇积累量降低及HCV滴度减小,并据此于2009年启动Ⅰ期临床试验。Ⅰ期临床结果同在非人灵长类动物模型中的结论一致,推动了Ⅱa期临床试验的开展。该项Ⅱa期研究在7个国际中心展开,研究人员评估了Miravirsen用于36例慢性HCV1型感染患者的安全性和有效性。试验表明Miravirsen用于慢性HCV1型感染患者表现出长期剂量依赖性地减少HCV RNA水平的效应,且未出现病毒抵抗性。值得关注的是,近期有报道表明,在体内外的测试中,随着Miravirsen使用剂量的提高,HCV病毒RNA的5’ UTR区域开始出现突变。虽然尚不清楚这些突变是否会导致抗药性的出现,对两者间相关性的分析迫在眉睫。
 RG-101:Regulus Therapeutics的重点产品之一(图5),是一类N-乙酰-D-氨基半乳糖修饰的抗miR-122核酸片段,已在HCV感染患者中开展Ⅰ期临床研究。试验中2-4mg/kg体重为有效剂量,可显著降低患者体内病毒滴度。对患者体内病毒数量反弹情况的长期监测表明,HVC水平低于定量范围。目前正在进行的一项Ⅱ期临床试验,将RG-101同Harvoni(Ledipasvir同Sofosbuvir联用)等直接抗病毒药物联用,用于测定能否延长治疗效果。中期数据表明,RG-101同Harvoni联用的响应率为100%,且24周内为观察到病毒复发。然而,随着第二例黄疸病例的出现,该项临床试验被美国FDA暂停。
RG-101:Regulus Therapeutics的重点产品之一(图5),是一类N-乙酰-D-氨基半乳糖修饰的抗miR-122核酸片段,已在HCV感染患者中开展Ⅰ期临床研究。试验中2-4mg/kg体重为有效剂量,可显著降低患者体内病毒滴度。对患者体内病毒数量反弹情况的长期监测表明,HVC水平低于定量范围。目前正在进行的一项Ⅱ期临床试验,将RG-101同Harvoni(Ledipasvir同Sofosbuvir联用)等直接抗病毒药物联用,用于测定能否延长治疗效果。中期数据表明,RG-101同Harvoni联用的响应率为100%,且24周内为观察到病毒复发。然而,随着第二例黄疸病例的出现,该项临床试验被美国FDA暂停。
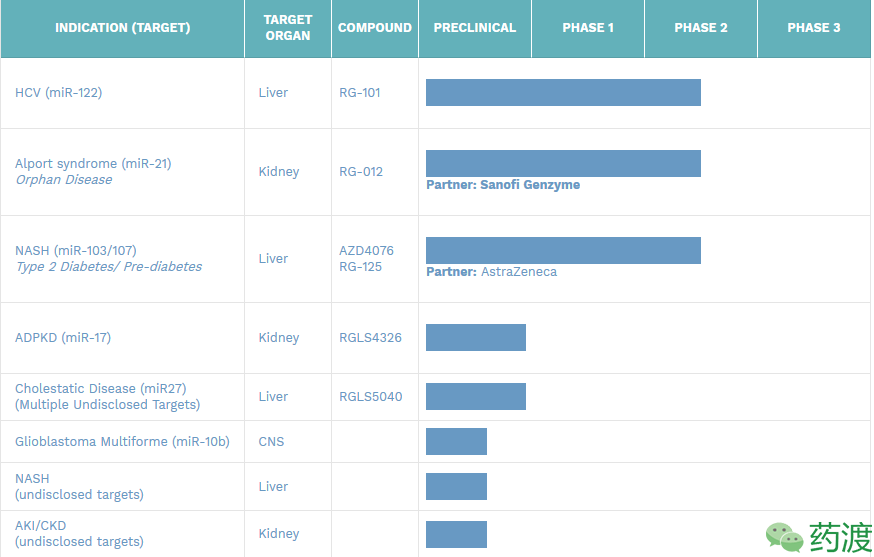
Fig5. Regulus Therapeutics pipeline and progress
MRX34:在肿瘤治疗领域,进展最快的miRNA类似物为MRX34 (Mirna Therapeutics,图6),后者包裹于名称为NOV40的脂质载体中。NOV40粒子的优势在于低pH环境下,如肿瘤细胞的微环境,外周会携带正电荷,从而可以粘附于肿瘤细胞上。在小鼠模型中,研究人员观测到了MRX34纳米颗粒在肿瘤组织中的富集及显著的肿瘤组织缩小。2013年,MRX34进入了一项多中心的Ⅰ期临床试验,用于原发性肝癌,小细胞肺癌,淋巴瘤,黑色素瘤,多发性骨髓瘤或肾细胞癌患者的治疗。该试验包括剂量递增研究,每周2次给药或每天5次给药,MRX34通过静脉注射的方式给药。2016年,该项研究招募了99位肝癌、非小细胞肺癌及胰腺癌患者受试。尽管取得一定疗效,但由于免疫相关的负面事件(包括患者死亡案例),该临床项目被终止。鉴于免疫反应的机制尚不明确,后续需进行更深入的临床前研究,特别是对于免疫相关毒性的关注。
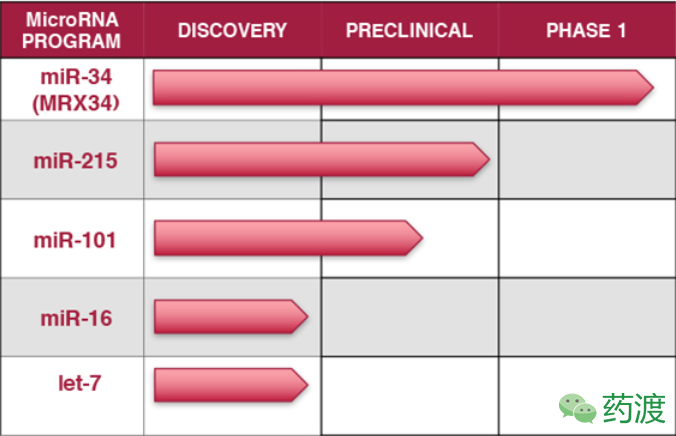
Fig6. Mirna Therapeutics pipeline and progress
MesomiR-1:EnGeneIC公司同澳大利亚悉尼的石棉病研究所联合开展了miR-16类似物对恶性胸膜间皮瘤或非小细胞肺癌患者的Ⅰ期临床试验。在第一个开放标签的安全性和有效性研究中,miR-16通过EGFR抗体包被的EDV纳米颗粒输送,从而靶向于肿瘤组织部位。在第一批招募的5位受试患者中,初步数据表现较为积极。
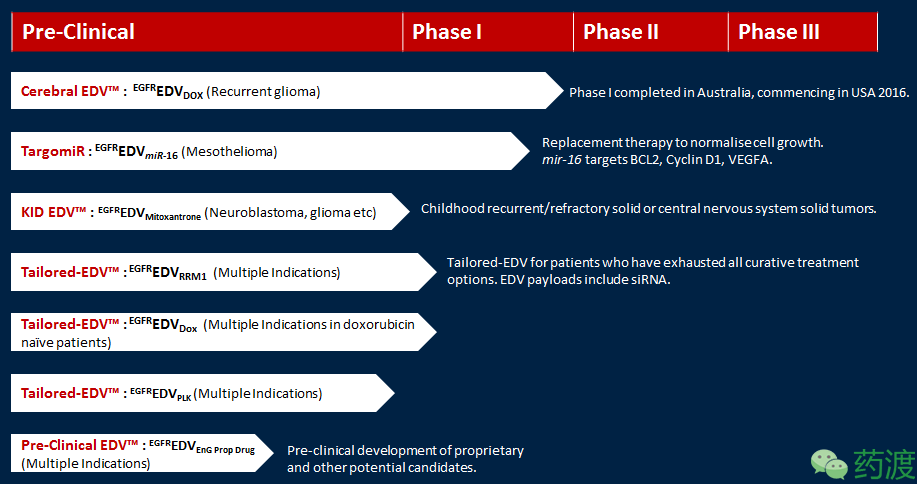
Fig7. EnGeneIC pipeline and progress
MRG-201及MRG-106:两者分别为针对硬皮病的miR-29类似物及针对蕈样肉芽肿型皮肤T细胞淋巴瘤的antimiR-155锁核苷酸,其对应的Ⅰ期临床试验已启动。两项研究的中期报告有望在2017年早些时候公布。
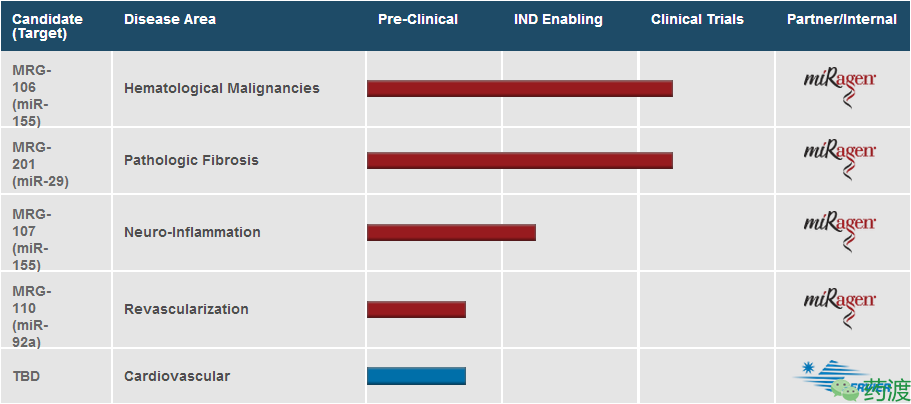
Fig8. mirage Therapeutics pipeline and progress
RG-125/AZD4076:非酒精性脂肪性肝炎(NASH)通常发生于患有肥胖症、血脂异常和糖耐量异常的个体中,并伴有胰岛素敏感性的降低。RG-125,一种N-乙酰半乳糖胺修饰的miR-103/107抑制分子,已进入NASH治疗的临床探索阶段。研究表明,mir-103/107基因在肥胖小鼠模型及NASH患者的肝脏中表达量明显上调;而caveolin 1则是miR-103/107的直接作用靶点,并于胰岛素信号及其敏感性相关。在临床前研究中,RG-125在具有胰岛素抗性的小鼠模型中表现良好,可显著增加机体的胰岛素敏感性。
缩略词表
AGO2: argonaute 2
ASOs: antisense oligonucleotides
EGFR: epidermal growth factor receptor
miRNA: micro RNA
RISC: RNA-induced silencing complex
UTR: untranslated region
DOPC: 1,2 dioleoyl-sn glycero‑3 phosphatidylcholine
eIF: eukaryotic initiation factor
GalNAc: N-acetyl-D-galactosamine
HBV: hepatitis B virus
LNA: locked nucleic acid
LNPs: lipid nanoparticles
RSV: respiratory syncytial virus
本文所参考文献:
1.MicroRNA therapeutics: towards a new era for the management of cancer and other diseases. Nature Reviews Drug Discovery (2017) doi:10.1038/nrd.2016.246
2.Therapeutic targeting of microRNAs: current status and future challenges. Nature Reviews Drug Discovery 13, 622–638 (2014)
3.MicroRNAs and other non-coding RNAs as targets for anticancer drug development. Nature Reviews Drug Discovery 12, 847–865 (2013)
4.Targeting microRNAs in cancer: rationale, strategies and challenges. Nature Reviews Drug Discovery 9, 775-789 (October 2010)
5.https://en.wikipedia.org/wiki/MicroRNA#miRNA_and_cancer
6.Current status of miRNA-targeting therapeutics and preclinical studies against gastroenterological carcinoma. Molecular and Cellular Therapies20131:5 DOI:10.1186/2052-8426-1-5
7.miRNA数据库: http://www.mirbase.org
