脊髓作为大脑与身体各部的“信息交通枢纽”,承载着至关重要的运动和感觉信号的传递任务。然而,一旦脊髓受损,就仿佛这条主要通道上发生了路障,导致信息传递受阻。这意味着,大脑给出的运动指示将无法触达和控制相应的肌肉,对患者的活动能力造成严重影响;另外,身体的感觉反馈也会被中断,导致患者对于热、冷、触觉或疼痛的感知变得模糊或完全消失。目前,脊髓损伤治疗还是很大的医学难题,因为我们并没有找到一种可以完全治愈的方法。因此,即使是拥有完备医疗团队的奥运冠军桑兰、著名作家张海迪或超人的扮演者克里斯托弗·里夫,他们遭遇脊髓受伤后也不得不经历生理和心理的重重挑战。
好消息是,科学界已经不断在努力寻找解决办法。比如上海交通大学医学院的韩齐课题组致力于神经损伤后的轴突再生和环路重建的研究,既往研究发现了增加神经元的能量供应可促进脊髓损伤后的神经再生和功能恢复[1],揭示了脊髓固有神经元在损伤运动环路重建的关键作用[2]。
脊髓损伤除了导致直接的运动和感觉障碍,还给患者带来了重大的心理创伤[3]。例如,据估计有约30%的患者出现抑郁症状[4],且这些症状常常持续并加重,增加了患者的自杀风险。有研究发现,在脊髓损伤的患者中,心理压力导致的自杀率是普通人群的3至5倍[5]。此外,长期的心理负性情绪可能影响患者的康复治疗效果和功能恢复进展[6]。然而,脊髓损伤中压力应激导致康复障碍的确切机制尚不清晰。
10月6日,上海交通大学医学院韩齐课题组,联合国家精神疾病医学中心(上海市精神卫生中心)、暨南大学、上海交通大学医学院附属仁济医院等单位,报道了持续心理应激(压力)通过影响背根节卫星胶质细胞和初级感觉神经元相互作用,调控感觉神经元中线粒体代谢功能,从而削弱轴突再生的新型细胞分子机制。论文发表在Science出版社旗下Science Advances(科学·进展)期刊上。

图一:论文扉页
研究团队首先对脊髓损伤患者与心理应激相关的激素进行了检测,发现压力激素-皮质醇的水平会发生明显的变化,这不仅对患者的心理健康有影响,而且还可能损害其神经的恢复能力。这些变化也可以用小鼠模型呈现出来。想要了解为什么会这样,研究团队进一步对背根节初级感觉神经元的转录组学分析,团队发现心理应激改变了神经元线粒体能量代谢相关的基因表达。线粒体就像我们身体的小电池,为细胞提供能量。当线粒体受损时,它制造能量的能力下降,这味着神经细胞得不到足够的能量来支持其修复再生。
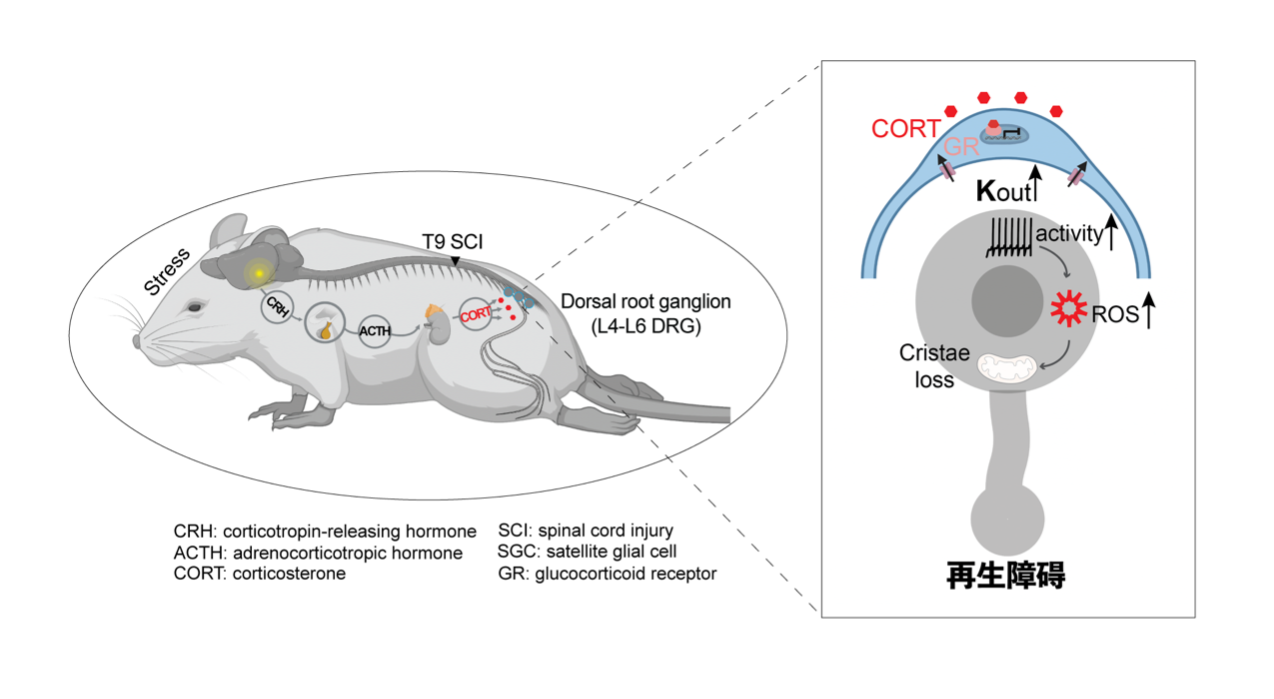
糖皮质激素受体是一种核受体,当与糖皮质激素结合后,它会转位到细胞核,调控特定基因的转录,是实现糖皮质激素功能效应的重要基础。为明确糖皮质激素作用的具体细胞类型,团队通过分别特异性敲除背根神经节内神经元和卫星胶质细胞的糖皮质激素受体,发现卫星胶质细胞的糖皮质激素受体可能参与神经轴突再生的调控。通过卫星胶质细胞与神经元的互作分析、在体电生理、细胞特异性功能缺失与获得等实验,团队发现卫星胶质细胞的钾离子通道Kir4.1在长期压力应激时受GR调控,表达出现下调,导致某些神经细胞变得过于活跃。
过度兴奋的神经元可能导致兴奋性毒性、过多的钙或者氧化应激,从而妨碍神经的再生。为了更清晰地了解这个过程,团队进一步通过免疫组织化学、化学遗传学抑制和ROS(reactive oxygen species)探针分析,发现了氧化应激中产生的ROS,是导致线粒体受损和神经再生受阻的主要因素。最后,他们使用了基因编辑技术CRISPR-dCas9,使细胞能够产生更多的可以清除ROS的酶。结果表明,这种方法确实可以改善神经的能量代谢和修复功能。
这一研究揭示了心理应激是影响脊髓损伤后神经再生的重要风险因素,解析了糖皮质激素通过背根节卫星胶质细胞上的Kir4.1通道调控神经元过度兴奋和氧化应激,最终导致线粒体损伤和轴突再生抑制的作用机制。针对糖皮质激素受体、Kir4.1通道和ROS的干预有望为神经保护和轴突再生提供新策略。在临床患者中,对心理压力及外周皮质醇激素水平的评估是评估康复障碍和预后的重要指标,通过心理治疗或神经调控治疗缓解心理应激,也有望为临床脊髓损伤患者的综合康复提供新手段。
研究团队的阮宇、程瑾、戴家峰和马政文为第一作者,韩齐、袁逖飞、周立兵、沈洪兴为论文通讯作者。该研究得到了科技创新2030-“脑科学与类脑研究”、国家自然科学基金委员会、上海市脑科学与类脑研究中心“求索杰出青年”、上海高校“东方学者”岗位计划、上海市高水平地方高校建设创新团队等基金的资助。同时,该研究得到了上海交通大学医学院基础医学院,以及医学院解剖学和生理学系、公共技术平台的大力支持。
参考文献
1. Han, Q., et al., Restoring Cellular Energetics Promotes Axonal Regeneration and Functional Recovery after Spinal Cord Injury. Cell Metabolism, 2020. 31(3): p. 623-641.e8.
2. Han, Q., et al., Descending motor circuitry required for NT-3 mediated locomotor recovery after spinal cord injury in mice. Nature Communications, 2019. 10(1): p. 5815.
3. Lim, S.W., et al., Anxiety and Depression in Patients with Traumatic Spinal Cord Injury: A Nationwide Population-Based Cohort Study. PLoS One, 2017. 12(1): p. e0169623.
4. Fann, J.R., et al., Venlafaxine Extended-Release for Depression Following Spinal Cord Injury: A Randomized Clinical Trial. JAMA Psychiatry, 2015. 72(3): p. 247-258.
5. Sanguinetti, R.D., et al., National survey of mental health and suicidal thoughts in people with spinal cord injury. Spinal Cord, 2022. 60(5): p. 444-450.
6. Tetreault, L., et al., Impact of Depression and Bipolar Disorders on Functional and Quality of Life Outcomes in Patients Undergoing Surgery for Degenerative Cervical Myelopathy: Analysis of a Combined Prospective Dataset. Spine, 2017. 42(6).