基础医学院生物化学与分子细胞生物学系的贾浩副研究员等最近在Molecular Therapy杂志上发表了题为“LncRNA IFITM4P is activated through LPS/TLR4 and promotes immune escape by up-regulating PD-L1 via dual mechanism during oral carcinogenesis”的学术文章。
口腔白斑病(oral leukoplakia)是最重要的口腔黏膜潜在恶性疾患之一,上皮异常增生是其病理学特征。世界卫生组织将口腔黏膜癌前病变和癌前状态归为口腔黏膜潜在恶性疾患,口腔白斑病从单纯上皮异常增生、轻-中-重度上皮异常增生到恶变的各阶段较明确,而且口腔部位相对表浅易于观测,可作为全身癌前病变的代表疾病,是癌前病变发生发展的良好研究模型。目前,药物的局部、全身治疗与手术、激光、冷冻、光动力等疗法均不能有效降低口腔白斑病的癌变率,并且口腔白斑病还存在易复发、多发、多次癌变等临床困境。因此,针对口腔白斑白斑病研发具有抑制和逆转作用的全身用药,特别是对于口腔黏膜具有区域化癌变潜能的患者,具有重要的临床意义和社会价值。
研究人员利用口腔黏膜白斑病组织和口腔鳞癌组织样本通过高通量筛选的方法,分析发现了PD-L1的表达水平随着组织恶性程度的增加而升高。局部炎症明显的口腔黏膜白斑病患者的恶性进展更快。在实验中首次构建了LPS(脂多糖)联合4NQO诱导的【炎症-口腔白斑小鼠模型】进行治疗研究,通过给患病小鼠注射PD-1抗体后,发现PD-1抗体可以显著阻断口腔白斑恶性进展,令人惊喜的是,PD-1抗体对炎症诱发的小鼠白斑恶性进展模型具有更好的抑制效果。
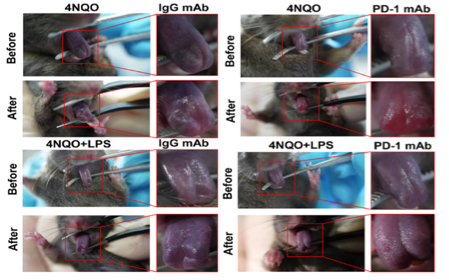
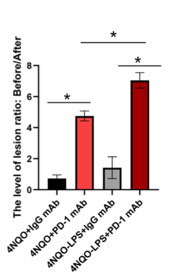
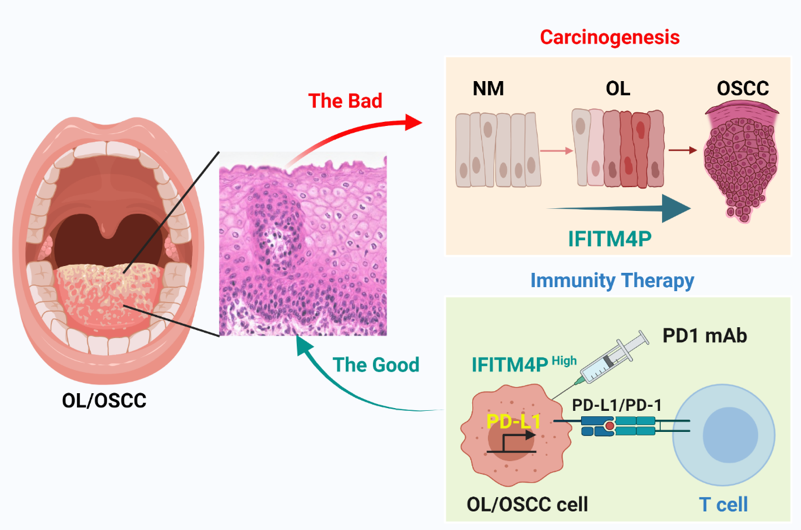
团队研究人员进一步利用基因高通量筛选发现:相较于正常组织,在人的口腔黏膜白斑病/鳞癌组织中长链非编码RNA IFITM4P高表达,其表达水平随着恶性程度的增加而升高。研究还发现了非编码RNA IFITM4P受LPS刺激后,可以进行核质穿梭,具体的原因还不清楚。在细胞质内,IFITM4P与SASH1形成复合体,通过磷酸化激活了TAK1-NF-κB途径,NF-κB的入核促进了PD-L1的表达。LPS的处理可以促进IFITM4P的入核,进一步通过招募去甲基化酶KDM5A结合并抑制了PTEN的表达,进而削弱了PTEN对PD-L1的抑制作用,上调了PD-L1的表达。IFITM4P通过胞质和胞核两种机制协同促进了口腔白斑/鳞癌细胞中PD-L1的表达,促使口腔黏膜白斑病发生免疫逃逸。因此,IFITM4P可作为早期诊断口腔黏膜白斑病恶变的指标。同时团队研究人员利用动物模型也发现了IFITM4P高表达的荷瘤小鼠对PD-1单抗的响应更好,可考虑将PD-1抗体作为治疗高表达IFITM4P口腔黏膜白斑病的有效治疗方式。
附属第九人民医院口腔黏膜病科副主任医生施琳俊,基础医学院生化细胞系硕士生杨于权,博士生李梦莹为该论文的共同第一作者;基础医学院的贾浩副研究员,侯照远研究员及附属第九人民医院口腔黏膜病科沈雪敏主任医师为该论文的共同通讯作者。该研究工作还得到了国家自然科学基金、上海市科技启明星,上海市科委等经费的资助。