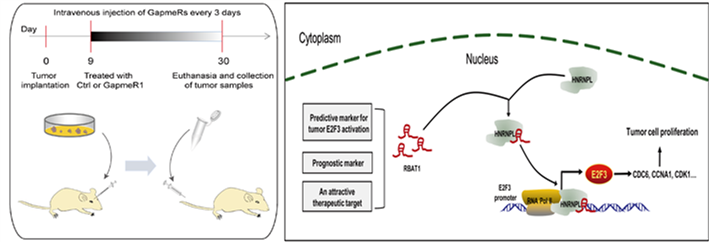
上海交通大学医学院范先群教授团队鉴定并命名了全新的长链非编码RNA RBAT1(Retinoblastoma Associated Transcript-1),发现lncRNA RBAT1可招募HNRNPL并顺式激活E2F3,靶向RBAT1/E2F3显著抑制视网膜母细胞瘤(Retinoblastoma,RB)发生。利用GapmeR小干扰片段在人源移植性肿瘤动物模型(Patient-Derived tumor Xenograft,PDX)中取得显著治疗效果,为视网膜母细胞瘤临床治疗提供新靶点。该项研究成果7月15日被国际学术期刊《分子癌症》(Molecular Cancer)在线发表。

视网膜母细胞瘤是一种起源于视网膜核层的胚胎性恶性肿瘤,多发生于3岁以下婴幼儿童,可单眼和双眼患病,具有家族遗传性,是婴幼儿眼病中性质最严重、危害性最大的一种恶性肿瘤,严重危害患儿生命。视网膜母细胞瘤主要由位于13号染色体的RB1基因突变导致。近年研究发现,表观遗传在RB的发生中起着重要作用。
上海交通大学医学院附属第九人民医院眼科多年来致力于视网膜母细胞瘤的临床治疗和基础研究。依托临床资源,培养并鉴定了多株RB原代细胞系和转移瘤细胞系,构建了眼肿瘤生物标本库,建立了RB人源移植瘤动物模型平台。研究团队发现RBAT1是一种新型的非编码转录本,是视网膜母细胞瘤中表达上调程度最高的lncRNA之一。细胞研究发现,通过矫正异常RBAT1表达,显著抑制视网膜母细胞瘤细胞的增殖与成瘤,并在小鼠移植瘤模型中观察到一致的效果;RBAT1在临床肿瘤样本中存在差异表达,且与患者预后密切相关。利用ChIRP-MS/RNA-seq等技术,发现长非编码RNA RBAT1可招募HNRNPL至靶基因启动子区,并顺式激活E2F3基因表达,促进视网膜母细胞瘤发生。在PDX动物模型中,应用反义寡核苷酸GapmeR小干扰片段介导的RBAT1沉默能显著抑制视网膜母细胞瘤的发生,表明靶向RBAT1/E2F3是视网膜母细胞瘤的的潜在治疗策略。
在前期研究中,范先群团队应用染色体构象捕捉等技术,首次发现视网膜母细胞瘤12号染色体上的GAU1新致病区,当GAU1所在致病区染色体构象形态由闭合向开放转变时,GAU1转录被激活,随后招募转录延长因子TCEA1形成GAU1-TCEA1复合物,该复合物能直接结合癌基因GALNT8启动子,激活GALNT8表达,促进肿瘤发生(Nucleic Acids Research,2018, IF=11.561)。研究发现,视网膜母细胞瘤不仅存在许多“致癌区”,也存在许多“抑癌区”。抑癌基因lncRNACANT1在视网膜母细胞瘤表达缺失,lncRNACANT1通过排斥组蛋白甲基化酶MLL复合物锚定至靶基因启动子区,抑制PI3K通路活性,从而抑制肿瘤发生(Cell Death & Disease, 2020)。
范先群团队开展RB多中心回顾性队列研究和前瞻性随机对照研究,发现眼动脉超选择介入化学治疗可显著提高RB的保眼率,提高视网膜母细胞瘤的治疗水平。