导 语
生物大分子的化学修饰在化学生物学研究、药物分子设计及分子探针开发中具有重要作用,能够为结构调控与功能拓展提供关键手段。近年来,利用可见光驱动的自由基反应实现大分子偶联逐渐受到关注,光化学条件温和且具备时空控制优势,因而在生物体系改造中展现出良好潜力。然而,在复杂生物环境中推进此类反应仍面临明显挑战:其一,传统光催化体系在细胞环境中的兼容性有限,较强的氧化条件容易造成蛋白质、核酸等生物大分子受损;其二,单电子转移过程在含多种生物成分的介质中易受到干扰,难以持续保持稳定而高效的反应效率,因此限制了光驱动自由基偶联在生物相关环境中的应用范围。

近年来,上海交通大学林厚文/廖洪泽团队基于底物直接光激发策略,在可见光诱导的偶联反应领域开展了系列研究,并取得代表性成果(Adv. Synth. Catal. 2023, 365, 3444; Green Chem. 2024, 26, 4742; Green Chem. 2024, 26, 10456)。在上述工作的基础上,该团队持续探索“无催化剂、可见光驱动”策略在更复杂体系中的可行性,并尝试将其应用拓展至生物相关环境。该团队近日在 Nature Communications 发表题为 “Biocompatible decarboxylative coupling enabled by N-hydroxynaphthalimide esters” 的论文,报道了一种无需催化剂、可见光驱动、具备高生物相容性的脱羧偶联策略,可在水溶液、细胞裂解液甚至活细胞中顺利进行,为在生物体系中开展自由基偶联反应提供了新的策略。
成果概述
研究团队发现,N-羟基萘酰亚胺酯(NHNI esters)能够在可见光照射下同时承担光吸收、底物活化与脱羧过程中的关键角色,由此构建出一类无需催化剂即可运行的脱羧偶联体系。依托其可见光吸收能力、稳定的三重态形成特性以及内在氧化活性,该体系能够在光照下诱导羧酸脱羧并生成烷基自由基,从而摆脱对金属光催化剂和预组装 EDA 复合物的依赖,显著提升了反应在水相及细胞环境中的可操作性。该策略简化了体系组成,同时提高了其与生物体系协同工作的可能性,为实现更温和、条件更兼容的光化学偶联提供了新的实现途径。
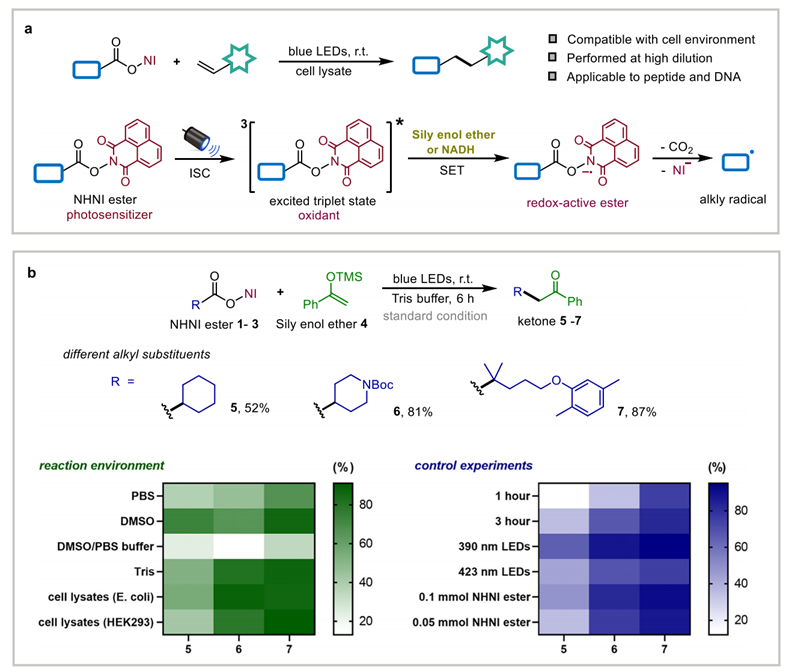
图一. NHNI 酯光化学反应平台及其生物环境兼容性概览(图源: Nat.Commun.)
图文解析
该工作深入探索了 NHNI 酯的化学结构特征,尤其是骨架具有的供体–受体(D–A)框架,对其激发态相关的光物理性质的影响:包括增强电荷转移特征、提高单重态向三重态的转换效率,并延长三重态寿命,从而整体提升脱羧偶联反应效率。如图示结果所示,引入 D–A 架构的化合物 2 和 3 相较于不含D-A特征的化合物 1,表现出更高比例的延迟发光成分和更长的磷光寿命,说明其三重态更易生成且更加稳定。延长的三重态寿命为单电子转移提供了更充足的时间窗,使反应在实际条件下获得更高的转化效率。量子化学计算进一步显示,化合物 1 的最高占据轨道与最低未占据轨道局域分布明显,而含 D–A 框架的化合物 2 与 3 则呈现空间明显分离的跃迁轨道,形成典型的电荷转移态(CT),从而降低单重态与三重态之间的能隙,提升单重态向三重态的跃迁可能性。上述实验与计算结果共同表明,NHNI 酯中 D–A 特征能够通过调控激发态行为促进三重态形成并提升其稳定性,从而有效提高光诱导脱羧过程的整体效率,为设计具有生物相容性的可见光反应体系提供了明确依据。
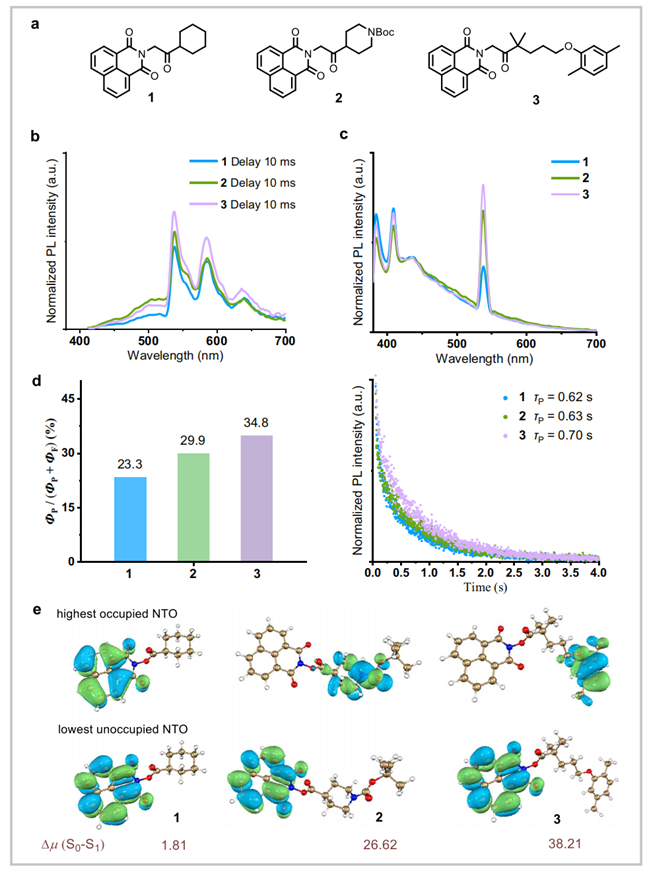
图二. NHNI 酯光物理性能与结构调控示意图(图源: Nat.Commun.)
该体系在多类底物上均展现出良好的反应性能。研究团队对五十余种小分子羧酸底物进行了系统验证,涵盖一级、二级与三级脂肪族羧酸,以及多种结构复杂的天然产物与药物分子(如 biotin、drimanic acid、gemfibrozil 等),均能在温和可见光照条件下顺利完成脱羧偶联,体现出方法的普适性。含杂原子的氨基酸与 α-羟基酸底物同样适配该体系。值得注意的是,在生物大分子体系中,该方法的适用性表现尤为突出。研究团队在固相树脂上对三个多肽化合物的进行原位 NHNI 酯化,并在 50% DMSO/Tris 缓冲体系中实现了光诱导偶联,成功实现多肽侧链的定点引入酮基结构,三个多肽底物均获得稳定反应效率。在核酸体系中,NHNI 酯可在常温和可见光条件下对带有 α,β-不饱和酰胺标签的 DNA-encoded library(DEL)头基进行高效烷基化,反应可在 50% DMSO/细胞裂解液条件中完成,且对核酸骨架未造成明显损伤。这些结果共同表明,NHNI 酯体系不仅适用于常规小分子反应,更在多肽与 DNA 等结构复杂、环境敏感的生物大分子体系中保持良好反应性与兼容性,为在生物相关环境下开展精准化学修饰提供了新的方法选择。
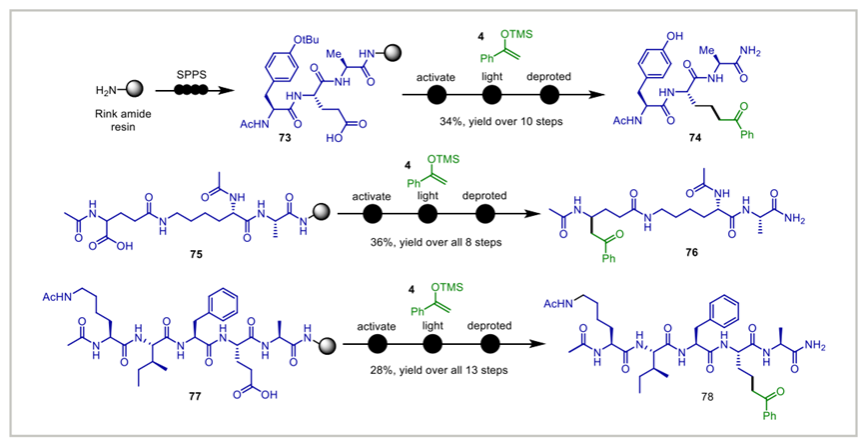
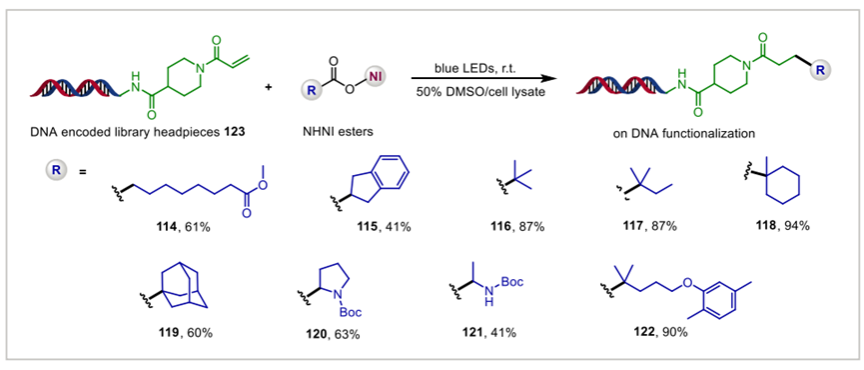
图三. NHNI 酯的光诱导脱羧策略在生物大分子偶联的应用(图源: Nat.Commun.)
特别值得注意的是,该体系能够在真实的活细胞环境中完成光诱导的自由基偶联反应,这是推动生物体系光化学应用的重要一步。研究团队将 NHNI 酯与硅烯醚共同处理于 HUVEC 细胞,并在蓝光照射下跟踪反应进程(如图所示)。共聚焦显微成像结果显示,NHNI 酯特征性的蓝色荧光信号随照射时间逐渐减弱,而细胞形态保持稳定,提示底物在细胞内部被持续消耗并参与光反应。随后对不同时间点的细胞裂解液进行高分辨质谱(HRMS)检测,成功捕获到目标偶联产物,说明该反应体系能够在细胞内完成自由基生成、电子转移与键构筑等关键步骤。整体结果表明,该方法不仅具有良好的生物相容性,更展现了在细胞尺度开展光化学转化的能力,为活细胞化学修饰、光控分子探针构建以及细胞内合成化学等方向提供了新的技术可能性。

图四. NHNI酯在活细胞中的可见光诱导脱羧偶联反应示意(图源: Nat.Commun.)
总 结
综上所述,研究团队成功提出了一种适用于生物体系的可见光诱导脱羧偶联策略,在反应设计、光物性调控、生物相容性以及细胞内应用等方面均展现出良好表现。作为面向化学生物学的重要工具,该方法未来有望进一步拓展至蛋白质与核酸的位点定向修饰、活细胞化学探针开发、光控药物与递送体系构建以及其他生物大分子连接技术等方向。总体而言,这一体系为构建可在复杂生命环境中运行的光化学反应提供了可借鉴的研究范式,也为发展新一代生物相容的光驱动化学工具奠定了基础。
课题组简介

林厚文教授(左)现任上海交通大学长聘教授、临床药学院院长、上海交通大学海洋药物融合创新中心主任,兼任仁济医院药学部主任、博士生导师,是国家杰出青年科学基金获得者和教育部长江学者特聘教授。长期以来,林教授致力于海洋复杂共生生物与微生物资源挖掘、活性天然产物发现、生物合成与结构修饰以及先导分子作用机制等方向的研究,团队构建了覆盖海洋药样本、活性组分和共生微生物的综合资源体系,已鉴定 1500 余种新型天然产物结构,并推动多项先导化合物进入后续研究。在抗肿瘤活性分子发现及评价方面,团队形成了较为系统的研究布局。林教授主持和参与了多项国家级科研项目,近年来团队在 Nature Communications、Nat. Chem. Biol.、J. Am. Chem. Soc. 等高水平期刊发表研究论文 200 余篇,培养了多名国家级青年科研人才,为推动我国医药化学及海洋药物研究的发展作出了重要贡献。林厚文教授曾获海洋科学技术奖一等奖、教育部科技进步一等奖,并入选“上海市科技精英”和“十大医学促进专家”等人才计划。
廖洪泽副研究员(右)现任上海交通大学医学院附属仁济医院药学部海洋药物融合创新中心副研究员,主要从事合成化学与药物化学研究,围绕海洋天然产物的全合成、新反应方法开发以及基于计算辅助的药物设计开展系统性工作,通过结构优化提升天然产物的生物活性与成药潜力。近年来,廖博士主持国家自然科学基金青年项目一项,作为项目骨干参与国家重点研发计划等多项科研任务,并在Green Chemistry、Advanced Science、Chemical Science、ACS Applied Materials Interfaces、Organic Letters等期刊发表SCI 论文二十余篇,曾入选“浦江人才计划”,并作为主要完成人获得海洋科学技术奖一等奖等荣誉。

林厚文课题组专注于海洋天然产物化学研究,围绕海洋复杂共生生物与微生物资源的系统挖掘、活性组分解析与结构改造,构建了覆盖海洋药样本、活性天然产物与共生微生物的综合研究平台。团队通过发展高效分离鉴定策略、全合成与半合成方法以及分子作用机制研究手段,系统探索海洋活性天然产物的结构多样性和生物学潜力,并推动部分先导化合物进入后续评价与应用阶段。依托平台化的资源体系与方法体系,课题组在抗肿瘤活性分子发现、先导化合物优化及天然产物药理机制等方面开展持续研究,为海洋药物发现及海洋生物资源利用提供了重要支撑。
论文信息
Liao, H., Su, Z., Zhang, J. et al. Biocompatible decarboxylative coupling enabled by N-hydroxynaphthalimide esters. Nat Commun 16, 10342 (2025). https://doi.org/10.1038/s41467-025-65244-7
供稿:廖洪泽
编辑:曹敏佳 张雪梅 金莎莎
审核:林厚文 顾智淳