李铮教授团队新成果:非梗阻性无精子症(Non-Obstructive Azoospermia, NOA)是最严重的精子发生障碍类型,总体发病率为男性人群的 1%,我国预估患者已高达 500 万。
由于对 NOA 病因与病程知之甚少,导致治疗手段极其匮乏,严重损害了男性健康与家庭社会和谐。精子发生依赖由多种体细胞构筑的成熟生精微环境。然而目前对于参与人类生精微环境的体细胞成熟过程及其在无精症患者的病理变化鲜有系统报道。
近日,上海交通大学附属第一人民医院李铮教授、上海科技大学生命科学与技术学院周智研究员团队,中科院上海高等研究院王晨琛研究员和上海交通大学医学院附属儿童医学中心孙杰教授合作于 Nature Communications 在线合作发表了睾丸生精微环境单细胞测序的最新研究成果,论文题目为 Single-cell analysis of developing and azoospermia human testicles reveals central role of Sertoli cells。
该研究详细描绘了人睾丸生精微环境中体细胞尤其是支持细胞的发育路径及其在男性不育患者中的病理变化特征。深入研究生理状态下生精微环境的建立和成熟过程,是理解 NOA 患者发病原因和病程的重要理论基础。通过对大年龄跨度的 10 名正常生精患者(2-31 周岁),来自于良性睾丸肿瘤等手术捐献组织睾丸组织进行单细胞测序,团队首先绘制了出生后人类睾丸各类细胞发育至成熟的转录组图谱,该图谱为后期各种生精障碍患者细胞的转录组状态提供了重要参照。
随后,团队以最严重的无精症 NOA 为着手点,收集了最常见的三类 NOA 患者(KS 克氏综合征、Y 染色体微缺失和特发性 NOA,几乎占 NOA 总量 90%)显微取精手术剩余组织进行单细胞测序。结果表明正常成人和 3 种 NOA 患者之间的睾丸支持细胞的转录状态发生了最显著的改变。
聚焦于支持细胞,时序分析表明生理状态下支持细胞成熟经历了 3 个连续且独立的发育阶段,更新了原本认为支持细胞只有成熟和不成熟两种状态的认知,而这一过程中支持细胞功能特征和调控通路的动态变化与精子发生过程的推进密切相关。
以支持细胞正常的发育路径作为标尺,团队发现特发性 NOA 支持细胞的转录组与正常的幼稚型支持细胞有约 80% 的重合度,表现为发育过程的谱系退化;而同样缺乏生殖细胞的 Y 染色体微缺失和克氏综合征患者的支持细胞与生理发育各阶段均不相似,表现为细胞凋亡、异常免疫反应和激素代谢紊乱等病理性变化。这也提示,找到促进支持细胞成熟的关键信号,将有助于改善特发性 NOA 患者支持细胞功能和生精微环境。
基于单细胞转录组数据进一步的通路分析,作者发现 Wnt/β-catenin 信号通路的激活是幼稚型支持细胞和特发性 NOA 支持细胞共有的典型特征,提示其在调控支持细胞成熟中的重要作用。在体外培养的支持细胞中加入 Wnt 通路抑制剂处理 14 天后,支持细胞趋于成熟。另外,与精原细胞共培养实验结果表明,诱导成熟的支持细胞与对照组相比能在更长时间段维持精原细胞的存活,提示其支持、营养生殖细胞功能的改善。
该研究阐明了参与微环境构筑的各类细胞发育进程,揭示了不同细胞类型之间的互作网络的动态变化。通过系统的比较正常发育和 NOA 患者的转录特征,发现了特发性 NOA 支持细胞谱系退化的特点,并且鉴定了 Wnt 通路作为诱导其成熟的潜在治疗靶点。这些发现为后续进一步阐明睾丸发育过程,探究生精障碍的发病机制,开发有效干预措施提供了新的理论基础与实验依据。
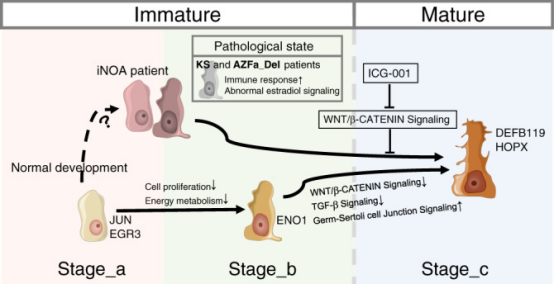
The schematic diagram of this study showed the normal developmental changes of Sertoli cells and their alterations in the three types of NOA patients. (Nat Commun. 2020 Nov 10;11(1):5683)
原文链接:https://pubmed.ncbi.nlm.nih.gov/33173058/



