慢性疼痛引起的抑郁症、记忆力减退和睡眠障碍等,严重降低患者生活质量。其中,睡眠问题尤为常见。我国有近3亿慢性疼痛患者,其中67%-88%存在睡眠问题,约50%符合失眠标准。慢性疼痛引起的失眠不仅会加剧疼痛,还会损害记忆、增加抑郁风险。尽管疼痛导致的失眠危害巨大,慢性疼痛如何导致睡眠障碍,其神经环路机制目前所知甚少。揭示慢性疼痛导致睡眠障碍的神经生物学机制,不仅有助于揭示睡眠和疼痛的发生机制,还可以为临床疼痛伴随睡眠障碍的干预提供新的治疗靶点。
近日,上海交通大学医学院松江研究院李亚东课题组、上海市第九人民医院麻醉科罗艳佳和复旦大学基础医学院黄志力/曲卫敏团队联合攻关,在解析慢性疼痛睡眠障碍核心机制上取得突破性进展,相关研究成果以《Anterior cingulate cortex projections to the dorsal medial striatum underlie insomnia associated with chronic pain》为题发表于神经科学顶级期刊《神经元》(Neuron)杂志。

前扣带回皮层(anterior cingulate cortex, ACC)是公认的痛感觉和痛情绪调控的核心脑区。ACC 内的锥体神经元 (Pyramidal neurons,PNs)已被证明可以控制慢性疼痛,但ACC未被视为睡眠觉醒中心。最近的证据表明ACC在特定条件中调节觉醒,例如新环境和抑郁等,这表明慢性疼痛中ACC PNs活性可能导致慢性疼性失眠。更为关键的是,研究团队前期工作表明,ACC主要输出核团背内侧纹状体(dorsal medial striatum, DMS)在睡眠-觉醒中起着关键作用(eLife 2017;Current Biology 2021)。由此研究人员提出假说:ACC-DMS神经环路可能是调控痛性失眠的核心结构。
研究人员首先证明了ACC PNs活性在痛性失眠中的变化。使用在体单光子钙成像技术,研究人员发现部分坐骨神经结扎(partial sciatic nerve ligation, PSNL)疼痛模型小鼠ACC PNs在失眠阶段钙信号活动显著增加,而在生理活跃期则未观察到明显变化。与非疼痛小鼠比较,疼痛小鼠模型在非活跃期的失眠阶段,大约62%的ACC PNs表现出钙信号活动增加,在活跃期只有大约21%的ACC PNs显示出这种变化。这些结果表明慢性疼痛导致的失眠异常激活ACC PNs。为了进一步确认痛性失眠是否特异性地激活了ACC PNs,研究人员进一步评估了催眠药(地西泮)、镇痛药(吗啡)或镇痛催眠药(加巴喷丁)处理后的ACC PNs钙信号活动情况。结果表明,只有加巴喷丁治疗能够将激活的ACC PNs数量降低至正常小鼠的水平。这一发现表明ACC PNs的过度活跃可能与痛性失眠密切相关。(图1)
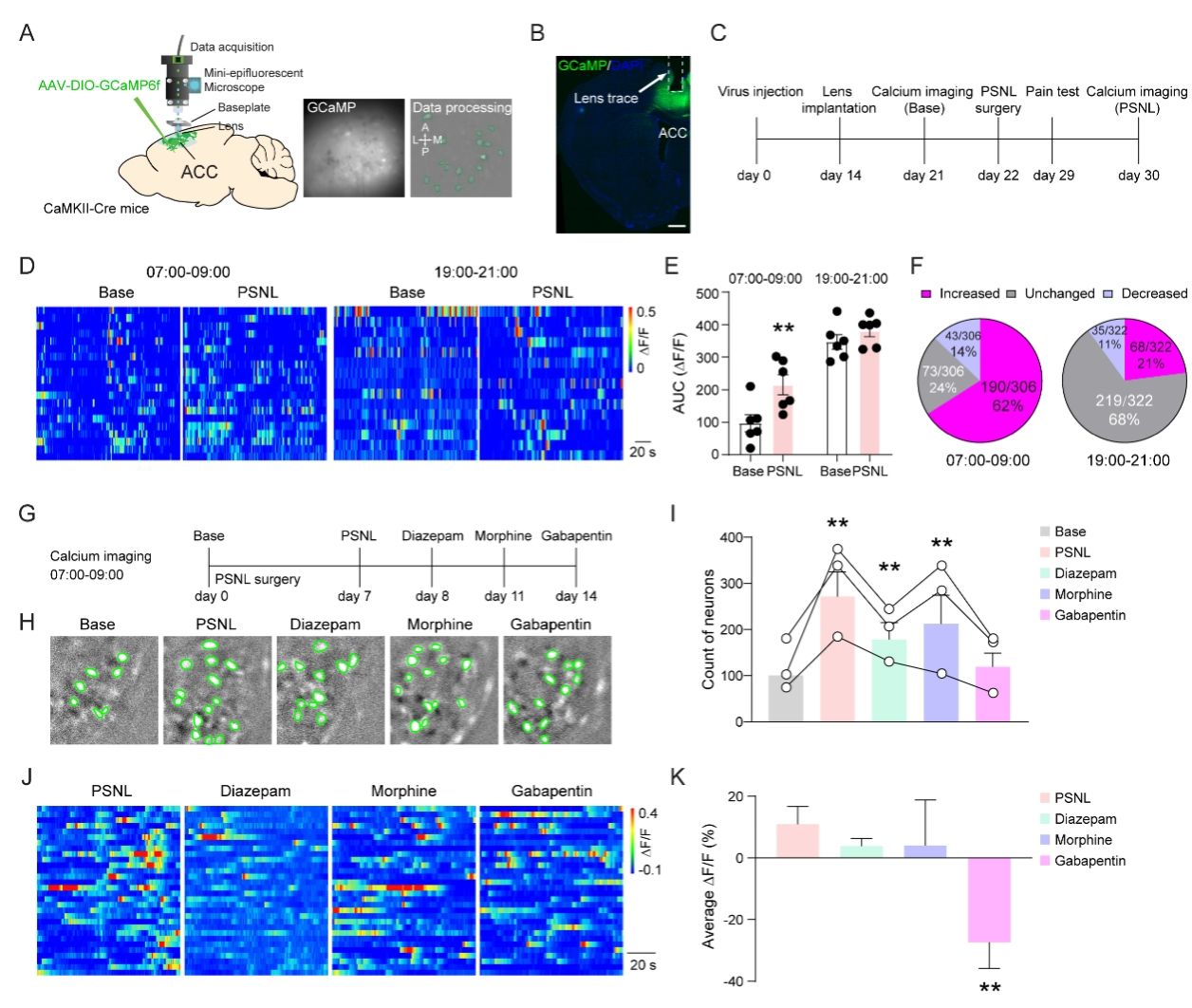
图1:PSNL小鼠中ACC PNs的异常激活与失眠有关
为了进一步证明ACC PNs在慢性疼痛失眠中的必要性,研究人员特异性毁损了ACC PNs。与仅表达eGFP的对照小鼠相比较,特异性凋亡ACC PNs的PSNL小鼠机械痛阈值有所提高,但未能恢复至正常水平。令人意外的是,毁损ACC PNs完全解除了慢性疼痛引起的失眠。以上结果表明 ACC PNs对痛性失眠是不可或缺的。相反,使用化学遗传学方法兴奋ACC PNs并未显著降低naive小鼠的机械痛阈值,却显著增加非活动期清醒时间。以上结果表明,ACC PNs的过度活跃在痛性失眠中起着重要作用(图2)。
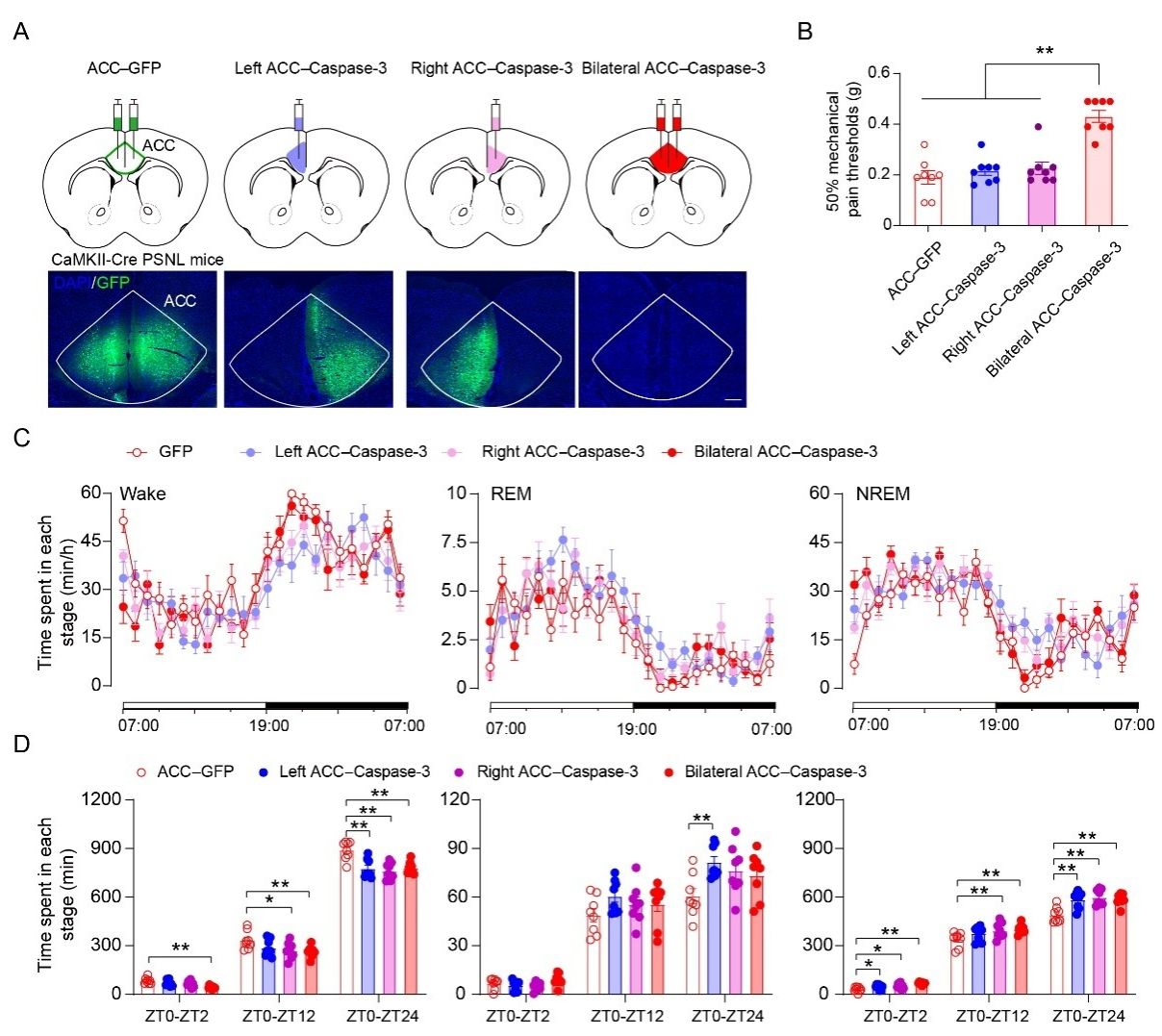
图2:双侧毁损ACC PNs阻断痛性失眠
那么ACC PNs的过度激活如何调控痛性失眠呢?为了解答这一疑问,研究人员解析了ACC-DMS环路。光遗传激活ACC-DMS投射显著增加了非疼痛小鼠觉醒量。与此相反,通过化学遗传学抑制投射DMS的ACC PNs神经元成功拯救了痛性失眠。以上结果表明ACC-DMS神经环路在痛性失眠中起着决定性作用。
在背内侧纹状体(DMS)中,存在两种不同类型的中型多棘神经元(medium spiny neurons,MSNs):D1R-MSNs和D2R-MSNs,这两种神经元分别调控觉醒和睡眠。那么D1R-MSNs和D2R-MSNs如何介导ACC过渡激活引起的失眠呢?研究人员通过体外电生理记录,对比分析了DMS中的D1R-MSNs和D2R-MSNs在慢性疼痛小鼠中的活动性和突触可塑性的变化。与假手术组相比,慢性疼痛显著提升了DMS内D1R-MSNs的突触前兴奋性输入和突触后的AMPA受体(AMPARs)功能,而对D2R-MSNs的自发性兴奋性突触后电流(sEPSCs)和微小兴奋性突触后电流(mEPSCs)的频率和振幅则无明显影响。与此同时,在PSNL小鼠中电极刺激ACC诱发DMS中D1R-MSNs AMPA受体(AMPAR)依赖的长时程增强(long-term potentiation,LTP)明显增加,但在D2R-MSNs中则出现了降低,这种现象可能与D2R-MSNs的突触前脉冲比(paired-pulse ratio,PPR)的增加有关。此外,研究人员还还采用光遗传学方法检测了NMDA受体(NMDAR) 介导的兴奋电流与 AMPAR介导的EPSC的比率(NMDAR/AMPAR比率)。研究发现,PSNL小鼠中的D1R-MSNs的NMDAR/AMPAR比率显著升高,而在D2R-MSNs中则没有显著变化。这些结果证明了慢性疼痛能够诱导ACC-DMS通路中D1R-MSNs的突触可塑性变化。最后,为了确定DMS中D1R-MSNs激活对痛性失眠的必要性,研究人员通过化学遗传学选择性抑制DMS中的D1R-MSNs。结果表明,化学遗传学选择性抑制DMS中的D1R-MSNs降低痛性失眠。以上结果表明,抑制DMS中的D1R-MSNs可以部分阻断慢性疼痛引起的失眠症状。
该研究表明,慢性疼痛引起ACC PNs过度活跃,进而通过DMS中D1R-MSNs突触可塑性的改变,调控了痛性失眠的发生(图3)。这一发现不仅阐明了ACC-DMS环路调控痛性失眠的核心作用,也为临床治疗由慢性疼痛引发的失眠症状提供了全新的方向。
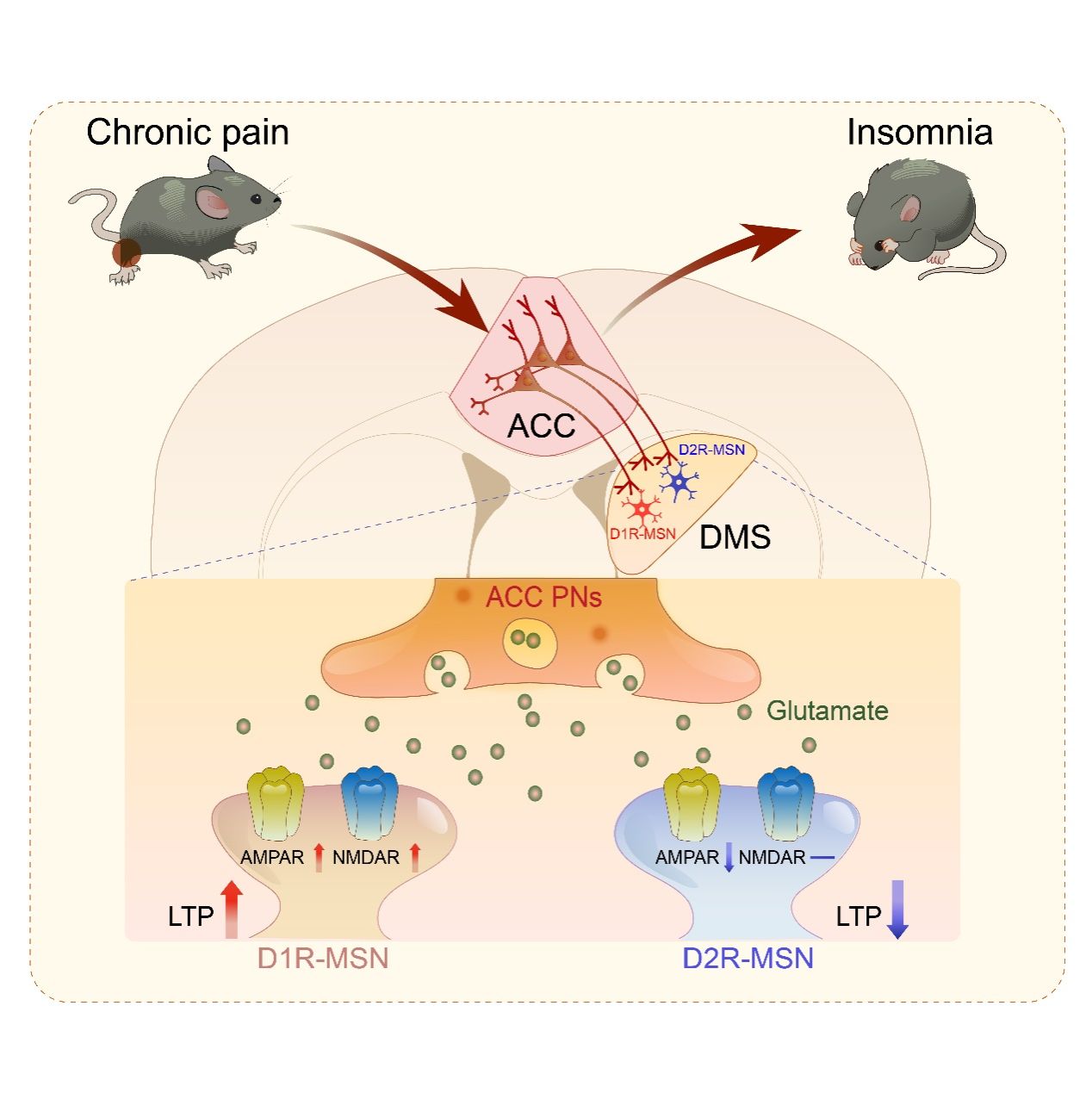
图3:ACC-DMS环路调控痛性失眠。
李亚东研究员、上海市第九人民医院麻醉科副研究员罗艳佳和李亚东课题组博士生苏伟坤为论文共同第一作者;李亚东、刘子龙、曲卫敏和黄志力为论文共同通讯作者。该研究得到筑波大学Michael Lazarus、UCSF Andrew Crowther、以及复旦大学睡眠课题组葛晶、陈泽卡和王露等人的大力支持。科技创新2030重大项目、国家自然科学基金和交大2030创新计划等对本项目提供了基金支持。
原文链接:https://www.cell.com/neuron/abstract/S0896-6273(24)00040-0
专家点评:
段树民 院士,上海交通大学医学院松江研究院院长
慢性痛相关睡眠障碍发生率高,危害严重。黄志力实验室专注于解析睡眠觉醒调控神经环路,特别是围绕基底神经节系统,取得了系列性研究结果。李亚东等在Neuron发表的最新研究显示,基底神经节的重要输入脑区前扣带回皮层是调控慢性痛失眠的核心脑区,慢性痛激活前扣带回皮层锥体神经元,增加背内侧纹状体D1受体阳性神经元活性,增加觉醒,减少睡眠。该发现丰富和发展了睡眠觉醒调控理论,进一步证明基底神经节系统在调控生理睡眠觉醒和病理性失眠中的重要作用。
曹君利,教育部长江学者,徐州医科大学副校长
慢性痛通常伴随有抑郁、失眠和认知损害等症状,其中痛性失眠会加剧抑郁和记忆损害等,但其发生机制研究较少。复旦大学黄志力课题组的最新研究表明,经典的疼痛脑区前扣带回皮层通过作用于睡眠觉醒核团调控痛性失眠。有趣的是,即便是毁损前扣带回皮层锥体神经元,疼痛只会缓解但不能完全阻断,但痛性失眠却能完全逆转。该研究表明,慢性疼痛和失眠既有其共同的神经环路,也有各自独特的调控机制。该研究为慢性疼痛和痛性失眠的干预提供的新的靶点。
上海交通大学医学院李亚东课题组诚聘副研究员和博士后各一名
李亚东研究员,上海交通大学医学院独立PI,博士生导师。李亚东课题组主要在生理和病理(神经退行性疾病、术后认知障碍)状态下,研究睡眠觉醒调控学习记忆的作用和机制。使用EEG/EMG记录、在体/离体电生理、高分辨率单/双光子成像、在体多通道钙信号记录、蛋白质组学和光/化学遗传学操控法等技术,研究团队发现了伏隔核和腹侧苍白球两个重要的觉醒核团(Molecular Psychiatry 2021;Nature Communications 2018;iScience 2023);揭示了前扣带回皮层调控痛性失眠的核心机制(PAIN 2019;Neuron 2024);阐明了下丘脑觉醒环路促进成年海马神经发生、改善记忆的独特机制,提出了干预觉醒改善学习记忆的新思路(eLife 2020;Nature Neuroscience 2022,Current Opinion in Neurobiology, 2023),并初步应用于AD认知障碍的干预(Cell Stem Cell 2023;JTM 2023)。课题组长近5年在Nature Neuroscience, Cell Stem Cell和Neuron等期刊连续发表第一或通讯作者论文10余篇,累积影响因子超过150。课题组已经构建由副研究员、博士后和研究生及科研助理等9人组成的研究团队。人员结构合理、实验平台完善。课题组长同时获得国家级和上海市人才项目和科研项目资助,经费充足。现诚聘副研究员(事业编制)和博士后各一名,热忱欢迎您的加入。联系方式:yadlee@126.com。
代表性论著:
Li YD, et al. (2024), Anterior cingulate cortex projections to the dorsal medial striatum underlie insomnia associated with chronic pain, Neuron, 2024.
Li YD, et al. (2023), Activation of hypothalamic-enhanced adult-born neurons restores cognitive and affective function in Alzheimer's disease, Cell Stem Cell 30 (3)
Li YD, et al. (2022), Hypothalamic modulation of adult hippocampal neurogenesis in mice confers activity-dependent regulation of memory and anxiety-like behavior, Nature Neuroscience 25, 630–645
Li YD, et al. (2021), Ventral pallidal GABAergic neurons control wakefulness associated with motivation through the ventral tegmental pathway, Molecular Psychiatry 26 (7), 2912-2928
Li YD, et al. (2020), Supramammillary nucleus synchronizes with dentate gyrus to regulate spatial memory retrieval through glutamate release, Elife 9, e53129
Li YD, et al. (2019), High cortical delta power correlates with aggravated allodynia by activating anterior cingulate cortex GABAergic neurons in neuropathic pain mice, Pain 161 (2), 288-299
Luo YJ, Li YD, et al. (2018), Nucleus accumbens controls wakefulness by a subpopulation of neurons expressing dopamine D1 receptors, Nature Communications 9 (1), 1576
Li YD, et al. (2023), Optimizing memory performance and emotional states: multi-level enhancement of adult hippocampal neurogenesis, Current Opinion in Neurobiology, 2023, 79
Luo YJ, …, Li YD (2023), Ventral pallidal glutamatergic neurons regulate wakefulness and emotion through separated projections, iScience, 26 (8)
Wander C. Li YD, et al. (2023), Compensatory remodeling of a septo-hippocampal GABAergic network in the triple transgenic Alzheimer’s mouse model, Journal of Translational Medicine, 21 (1), 258

李亚东课题组合照
