2023年8月31日,国际知名生物学期刊《Cell Reports》期刊在线发表了题为《Taok1单倍剂量不足在中缝背核导致小鼠孤独症样行为》的研究论文(https://www.cell.com/cell-reports/fulltext/S2211-1247(23)01089-6 )。该研究由上海交通大学医学院松江研究院/中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)/上海交通大学医学院附属新华医院教育部上海市环境与儿童健康重点实验室仇子龙研究组完成。
孤独症谱系障碍(Autism spectrum disorder),又称自闭症,是一类婴幼儿时期发病的神经系统发育性疾病,主要临床特征为社交障碍和重复刻板行为,在中国发病率约为0.29%1。孤独症发生与遗传因素高度相关2,单基因突变已被证明能够解释至少10-15%孤独症患者的发病原因3。随着孤独症遗传测序项目的广泛开展,鉴定得到了越来越多的孤独症风险基因,单基因突变可解释的患病比例也不断增加4。
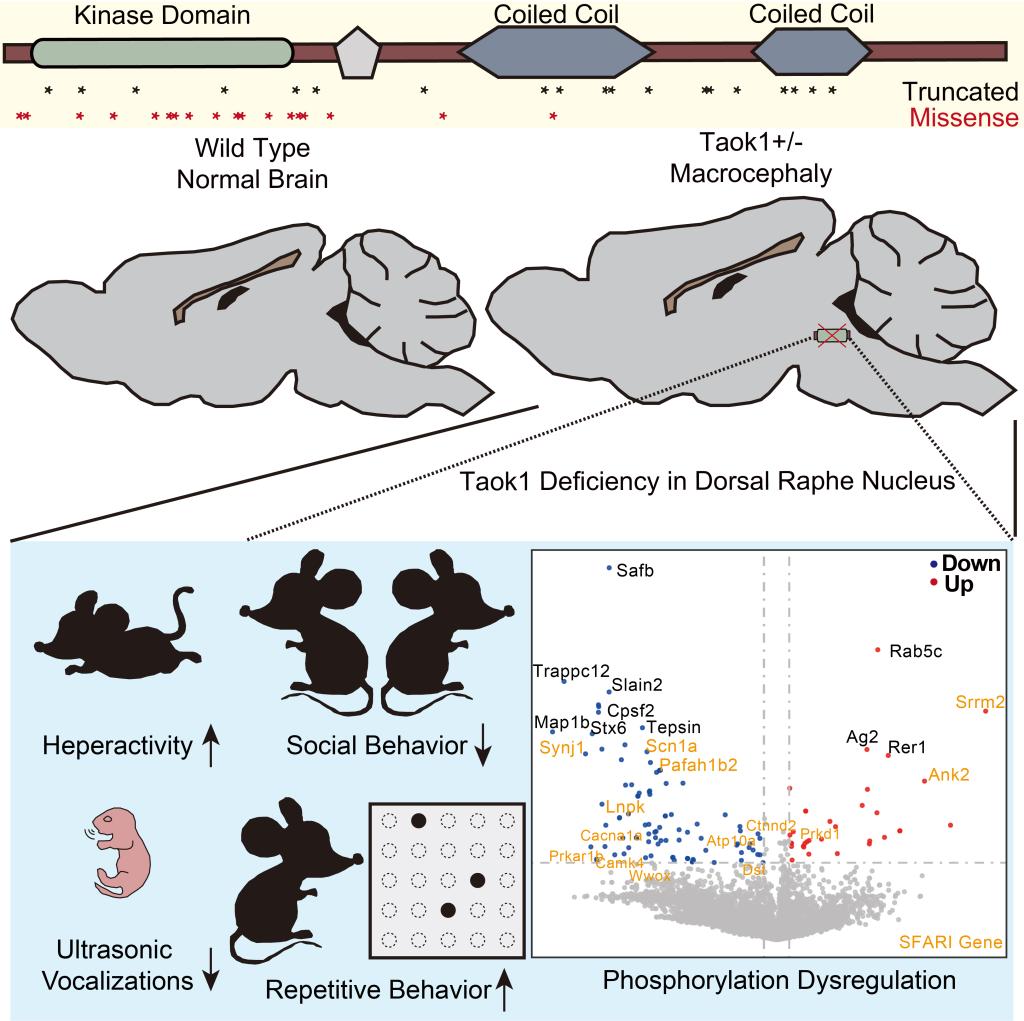
仇子龙研究团队在与上海交大医学院附属新华医院李斐主任合作过程中,在772个孤独症核心家系的全外显子组二代测序数据里5,关注到一个位于TAOK1基因上的新发移码突变。与 TAOK1 相关的神经发育障碍已于2021年被OMIM(Online Mendelian Inheritance in Man)正式收录,编号为 MIM # 619575。TAOK1突变相关的神经发育障碍具有较高的异质性,常见症状包括孤独症,智力障碍,行为异常,新生儿喂养困难,张力减退,面部畸形,畸形巨头,关节松弛等。在孤独症人群中开展的大规模二代测序,进一步提供了 TAOK1 与神经发育障碍疾病相关的证据。TAOK1 目前已经被认为是一个孤独症高置信度的风险基因,并被 SFARI Gene收录,但是关于TAOK1的致病机制还鲜有报道。
研究团队结合小鼠遗传学、动物行为学与组织化学等实验发现,Taok1单倍剂量不足可以导致小鼠出现幼鼠发声异常,社交偏好降低,重复刻板行为等孤独症核心症状,同时伴有头部膨大,皮层神经元迁移异常,前肢拉力下降,体重下降等发育异常表型。利用免疫荧光染色和行为相关神经元靶向重组技术(targeted recombination in active populations,TRAP),研究团队发现Taok1在中缝背核(dorsal raphenucleus,DRN)中存在特异表达,且DRN神经元兴奋性与孤独症样表型相关。结合稀疏标记技术,电镜和磷酸蛋白质谱技术,证明Taok1缺失会导致DRN神经元结构和磷酸化网络异常。通过条件性敲除DRN或vGlut3阳性神经元中的Taok1足以导致小鼠产生孤独症样表型。在成年期回补野生型而非激酶功能异常型TAOK1可以挽救Taok1单倍剂量不足小鼠的孤独症样表型。
该研究首次构建了一个模拟神经发育障碍疾病的TAOK1基因单倍剂量不足模型小鼠,并证明了其在孤独症和神经发育研究领域作为模型小鼠研究的可能性。在遗传机制上,证明了单倍剂量不足是TAOK1突变致病的一种可能机制。该研究进一步为DRN对于调控孤独症核心表型提供了证据,并提示DRN磷酸化网络和vGLut3神经元功能异常与孤独症发生具有相关性。这一发现为深入理解孤独症发生的机制提供了重要证据,为进一步干预和改善孤独症核心症状提供了全新思路。
该研究主要由中科院脑智卓越中心王锦程博士完成,上海交大医学院松江研究院/中科院脑智卓越中心仇子龙资深研究员为该论文通讯作者。中科院脑智卓越中心李维克博士,博士研究生李子萌,石玉含博士,单仕芳,松江研究院张月芳,袁依婷,韩文建博士,和上海交通大学附属第九人民医院薛震宇共同参与了此项研究。研究还获得了中科院脑智卓越中心光学平台,实验动物平台,电镜技术平台,基因编辑平台,分子细胞技术平台,许晓鸿研究组和上海易算生物科技有限公司的大力支持。
参考文献
1. Zhou, H., Xu, X., Yan, W., Zou, X., Wu, L., Luo, X., Li, T., Huang, Y., Guan, H., Chen, X., et al. (2020). Prevalence of Autism Spectrum Disorder in China: A Nationwide Multi-center Population-based Study Among Children Aged 6 to 12 Years. Neurosci Bull 36, 961-971. 10.1007/s12264-020-00530-6.
2. Folstein, S., and Rutter, M. (1977). Genetic influences and infantile autism. Nature 265, 726-728. 10.1038/265726a0.
3. Sztainberg, Y., and Zoghbi, H.Y. (2016). Lessons learned from studying syndromic autism spectrum disorders. Nat Neurosci 19, 1408-1417. 10.1038/nn.4420.
4. Spark (2018). SPARK: A US Cohort of 50,000 Families to Accelerate Autism Research. Neuron 97, 488-493. 10.1016/j.neuron.2018.01.015.
5. Wang, J., Yu, J., Wang, M., Zhang, L., Yang, K., Du, X., Wu, J., Wang, X., Li, F., and Qiu, Z. (2023). Discovery and validation of novel genes in a large Chinese ASD cohort. Biol Psychiatry. 10.1016/j.biopsych.2023.06.025.
